2012/414/EU2012/414/EU: Prováděcí rozhodnutí Komise ze dne 17. července 2012 , kterým se mění přílohy I až IV rozhodnutí 2006/168/ES, pokud jde o některé požadavky na veterinární osvědčení pro dovoz embryí skotu do Unie (oznámeno pod číslem C(2012) 4816) Text s významem pro EHP
| Publikováno: | Úř. věst. L 194, 21.7.2012, s. 12-25 | Druh předpisu: | Prováděcí rozhodnutí |
| Přijato: | 17. července 2012 | Autor předpisu: | Evropská komise |
| Platnost od: | 18. července 2012 | Nabývá účinnosti: | 1. ledna 2013 |
| Platnost předpisu: | Zrušen předpisem (EU) 2021/404 | Pozbývá platnosti: | 21. dubna 2021 |
Text aktualizovaného znění s celou hlavičkou je dostupný pouze pro registrované uživatele.
Tento dokument je třeba brát jako dokumentační nástroj a instituce nenesou jakoukoli odpovědnost za jeho obsah
|
PROVÁDĚCÍ ROZHODNUTÍ KOMISE ze dne 17. července 2012, kterým se mění přílohy I až IV rozhodnutí 2006/168/ES, pokud jde o některé požadavky na veterinární osvědčení pro dovoz embryí skotu do Unie (oznámeno pod číslem C(2012) 4816) (Text s významem pro EHP) (Úř. věst. L 194, 21.7.2012, p.12) |
Opraveno:
PROVÁDĚCÍ ROZHODNUTÍ KOMISE
ze dne 17. července 2012,
kterým se mění přílohy I až IV rozhodnutí 2006/168/ES, pokud jde o některé požadavky na veterinární osvědčení pro dovoz embryí skotu do Unie
(oznámeno pod číslem C(2012) 4816)
(Text s významem pro EHP)
(2012/414/EU)
EVROPSKÁ KOMISE,
s ohledem na Smlouvu o fungování Evropské unie,
s ohledem na směrnici Rady 89/556/EHS ze dne 25. září 1989 o veterinárních otázkách obchodu s embryi skotu ve Společenství a dovozů těchto embryí ze třetích zemí ( 1 ), a zejména na čl. 7 odst. 1 a čl. 9 odst. 1 první pododstavec písm. b) uvedené směrnice,
vzhledem k těmto důvodům:|
(1) |
Rozhodnutí Komise 2006/168/ES ze dne 4. ledna 2006, kterým se stanoví veterinární podmínky a požadavky na veterinární osvědčení pro dovoz embryí skotu do Společenství a kterým se ruší rozhodnutí 2005/217/ES ( 2 ), stanoví v příloze I seznam třetích zemí, z nichž členské státy povolují dovoz embryí skotu (dále jen „embrya“). Stanoví také doplňkové záruky týkající se konkrétních nákaz zvířat, které mají určité třetí země uvedené v dané příloze poskytnout. |
|
(2) |
V rozhodnutí 2006/168/ES se rovněž stanoví, že členské státy povolí dovoz embryí, která jsou v souladu s veterinárními požadavky uvedenými ve vzorových veterinárních osvědčeních v přílohách II, III a IV uvedeného rozhodnutí. |
|
(3) |
Veterinární požadavky týkající se katarální horečky ovcí ve vzorovém veterinárním osvědčení v přílohách II, III a IV rozhodnutí 2006/168/ES jsou založeny na doporučeních kapitoly 8.3 Kodexu zdraví suchozemských živočichů Světové organizace pro zdraví zvířat (OIE), která se týká katarální horečky ovcí. Uvedená kapitola obsahuje celou řadu opatření ke zmírnění rizik zaměřených buď na ochranu hostitelů z řad savců před expozicí vektoru infekce, nebo na inaktivaci viru protilátkami. |
|
(4) |
Světová organizace pro zdraví zvířat dále v rámci Kodexu zdraví suchozemských živočichů stanovila kapitolu o dozoru nad členovci, kteří jsou přenašeči nákaz zvířat. V ní uvedená doporučení nezahrnují sledování přežvýkavců na protilátky virů Simbu, jako jsou viry Akabane a Aino čeledi Bunyaviridae, což bylo v minulosti do doby, než bylo k dispozici více informací o šíření těchto nákaz, považováno za úspornou metodu stanovení výskytu vektorů katarální horečky ovcí. |
|
(5) |
Světová organizace pro zdraví zvířat rovněž nákazy Akabane a Aino neuvádí v Kodexu zdraví suchozemských živočichů. Požadavek každoročního vyšetření na tyto nákazy k prokázání nepřítomnosti vektoru by proto měl být v příloze I rozhodnutí 2006/168/ES a ve vzorovém veterinárním osvědčení v příloze II, III a IV uvedeného rozhodnutí zrušen. |
|
(6) |
Kromě toho byly uzavřeny dvoustranné dohody mezi Unií a některými třetími zeměmi, které obsahují zvláštní podmínky pro dovoz embryí do Unie. V zájmu jednotnosti by proto v případě, že tyto dvoustranné dohody obsahují specifické podmínky a vzorová veterinární osvědčení pro dovoz, měly být místo podmínek a vzorů stanovených v rozhodnutí 2006/186/ES použity uvedené podmínky a vzory. |
|
(7) |
Nákazový status ve Švýcarsku je rovnocenný statusu členských států. Proto je vhodné, aby embrya získaná in vivo a vyprodukovaná in vitro dovážená do Unie z uvedené třetí země byla doprovázena veterinárním osvědčením vypracovaným v souladu se vzorem osvědčení pro obchod uvnitř Unie, které se používá v případě obchodu s embryi skotu v rámci Unie a které je uvedeno v příloze C směrnice 89/556/EHS. Dané osvědčení by mělo zohlednit úpravy stanovené v dodatku 2 kapitole VI oddíle B bodě 2 přílohy 11 Dohody mezi Evropským společenstvím a Švýcarskou konfederací o obchodu se zemědělskými produkty, schválené rozhodnutím Rady a Komise 2002/309/ES, Euratom týkajícím se dohody o vědeckotechnické spolupráci, ze dne 4. dubna 2002 o uzavření sedmi dohod se Švýcarskou konfederací ( 3 ). |
|
(8) |
Směrnicí 89/556/EHS byl jako třetí země s nákazovým statusem rovnocenným statusu členských států pro dovoz embryí získaných in vivo rovněž uznán Nový Zéland. |
|
(9) |
Proto je vhodné, aby embrya získaná in vivo, která byla odebrána na Novém Zélandu a z této třetí země dovezena do Unie, byla doprovázena zjednodušeným osvědčením vypracovaným v souladu s příslušným vzorovým veterinárním osvědčením stanoveným v příloze IV rozhodnutí Komise 2003/56/ES ze dne 24. ledna 2003 o veterinárních osvědčeních pro dovoz živých zvířat a živočišných produktů z Nového Zélandu ( 4 ) v souladu s Dohodou mezi Evropským společenstvím a Novým Zélandem o hygienických opatřeních použitelných při obchodu s živými zvířaty a živočišnými produkty ( 5 ), schválenou rozhodnutím Rady 97/132/ES ( 6 ). |
|
(10) |
Rozhodnutí Komise 2007/240/ES ( 7 ) stanoví, že předkládání různých veterinárních osvědčení a osvědčení o zdravotní nezávadnosti vyžadovaných pro dovoz živých zvířat, spermatu, embryí, vajíček a produktů živočišného původu do Unie probíhá na základě jednotných vzorů veterinárních osvědčení uvedených v příloze I uvedeného rozhodnutí. V zájmu jednotnosti a zjednodušení právních předpisů Unie by vzorová veterinární osvědčení stanovená v přílohách II, III a IV rozhodnutí 2006/168/ES měla zohledňovat rozhodnutí 2007/240/ES. |
|
(11) |
Přílohy I až IV rozhodnutí 2006/168/ES by proto měly být odpovídajícím způsobem změněny. |
|
(12) |
Aby nedošlo k narušení obchodu, mělo by být za určitých podmínek v přechodném období povoleno používání veterinárních osvědčení vydaných v souladu s rozhodnutím 2006/168/ES ve znění platném před zavedením změn na základě tohoto rozhodnutí. |
|
(13) |
Opatření stanovená tímto rozhodnutím jsou v souladu se stanoviskem Stálého výboru pro potravinový řetězec a zdraví zvířat, |
PŘIJALA TOTO ROZHODNUTÍ:
Článek 1
Přílohy I až IV rozhodnutí 2006/168/ES se mění v souladu s přílohou tohoto rozhodnutí.
Článek 2
Po přechodné období do 30. června 2013 budou členské státy nadále povolovat dovoz zásilek embryí skotu ze třetích zemí, které jsou doprovázeny veterinárním osvědčením vydaným nejpozději 31. května 2013 v souladu se vzory stanovenými v přílohách II, III a IV rozhodnutí 2006/168/ES ve znění platném před zavedením změn na základě tohoto rozhodnutí.
Článek 3
Toto rozhodnutí se použije ode dne 1. ledna 2013.
Článek 4
Toto rozhodnutí je určeno členským státům.
PŘÍLOHA
Přílohy I až IV rozhodnutí 2006/168/ES se nahrazují tímto:
„PŘÍLOHA I
|
Kód ISO |
Třetí země |
Použitelné veterinární osvědčení |
||
|
AR |
Argentina |
PŘÍLOHA II |
PŘÍLOHA III |
PŘÍLOHA IV |
|
AU |
Austrálie |
PŘÍLOHA II |
PŘÍLOHA III |
PŘÍLOHA IV |
|
CA |
Kanada |
PŘÍLOHA II |
PŘÍLOHA III |
PŘÍLOHA IV |
|
CH |
Švýcarsko (1) |
PŘÍLOHA II |
PŘÍLOHA III |
PŘÍLOHA IV |
|
HR |
Chorvatsko |
PŘÍLOHA II |
PŘÍLOHA III |
PŘÍLOHA IV |
|
IL |
Izrael |
PŘÍLOHA II |
PŘÍLOHA III |
PŘÍLOHA IV |
|
MK |
Bývalá jugoslávská republika Makedonie (2) |
PŘÍLOHA II |
PŘÍLOHA III |
PŘÍLOHA IV |
|
NZ |
Nový Zéland (3) |
PŘÍLOHA II |
PŘÍLOHA III |
PŘÍLOHA IV |
|
US |
Spojené státy |
PŘÍLOHA II |
PŘÍLOHA III |
PŘÍLOHA IV |
|
(1) Osvědčení, která se v případě embryí získaných in vivo a vyprodukovaných in vitro použijí pro dovoz ze Švýcarska, jsou stanovena v příloze C směrnice 89/556/EHS, s úpravami uvedenými v dodatku 2 kapitole VI oddíle B bodě 2 přílohy 11 Dohody mezi Evropským společenstvím a Švýcarskou konfederací o obchodu se zemědělskými produkty, schválené rozhodnutím Rady a Komise 2002/309/ES, Euratom týkajícím se dohody o vědeckotechnické spolupráci, ze dne 4. dubna 2002 o uzavření sedmi dohod se Švýcarskou konfederací. (2) Prozatímní kód, kterým není dotčeno konečné označení země, které bude stanoveno po ukončení jednání probíhajících v současné době v Organizaci spojených národů. (3) Osvědčení, které se v případě embryí získaných in vivo použije pro dovoz z Nového Zélandu, je stanoveno v příloze IV rozhodnutí Komise 2003/56/ES ze dne 24. ledna 2003 o veterinárních osvědčeních pro dovoz živých zvířat a živočišných produktů z Nového Zélandu (týká se pouze embryí odebraných na Novém Zélandu) v souladu s Dohodou mezi Evropským společenstvím a Novým Zélandem o hygienických opatřeních použitelných při obchodu s živými zvířaty a živočišnými produkty, schválenou rozhodnutím Rady 97/132/ES. |
||||
PŘÍLOHA II
Vzorové veterinární osvědčení pro dovoz embryí skotu získaných in vivo, která byla odebrána v souladu se Směrnicí Rady 89/556/EHS
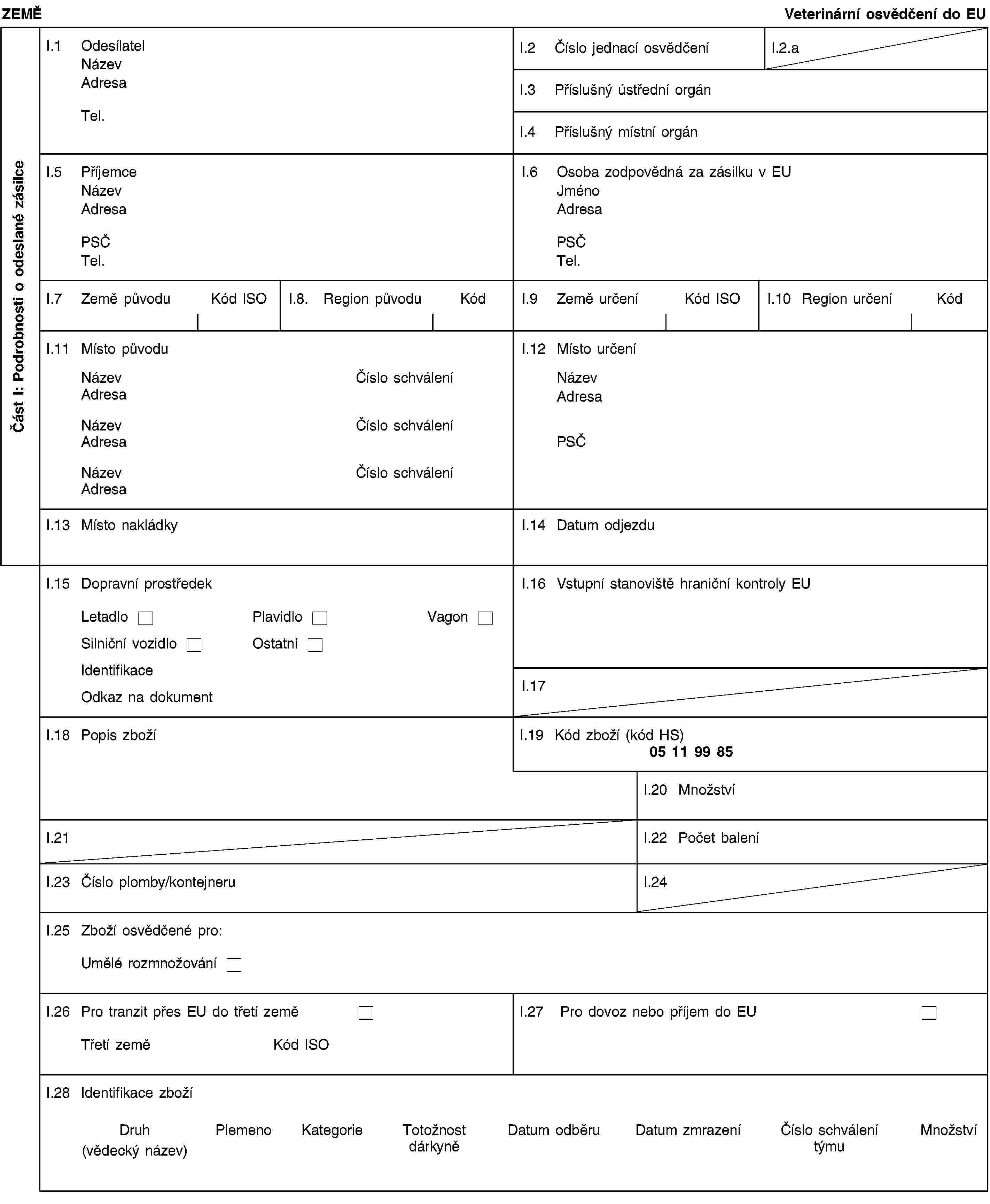
 nebo [II.1.1.2 nebyla během 12 měsíců bezprostředně před odběrem embryí prostá slintavky a kulhavky a/nebo prováděla v uvedeném období očkování proti slintavce a kulhavce, a:u embryí nedošlo k penetraci zona pellucida,embrya byla nejméně po dobu 30 dní bezprostředně po odběru skladována ve schválených podmínkách,dárkyně pocházejí z hospodářství, ve kterých žádné zvíře nebylo očkováno proti slintavce a kulhavce během 30 dní před odběrem a žádné zvíře vnímavých druhů nevykazovalo klinické příznaky slintavky a kulhavky během 30 dní před odběrem embryí a nejméně 30 dní po odběru embryí;]II.1.2 byla odebrána týmem pro odběr embryí (3), který:byl schválen v souladu s přílohou A kapitolou I směrnice 89/556/EHS,provedl odběr, ošetření, skladování a přepravu embryí v souladu s přílohou A kapitolou II směrnice 89/556/EHS,je nejméně dvakrát ročně kontrolován úředním veterinárním lékařem;II.1.3 byla odebrána a ošetřena v prostorách nacházejících se ve středu oblasti o poloměru nejméně 10 km, v níž se podle úředních zjištění nevyskytl žádný případ slintavky a kulhavky, epizootického hemoragického onemocnění, vezikulární stomatitidy, horečky Údolí Rift nebo plicní nákazy skotu, a to během 30 dní bezprostředně před odběrem a do doby odeslání do Unie v případě čerstvých embryí, nebo během 30 dní po odběru v případě embryí, která byla v souladu s bodem II.1.1.2 povinně skladována po dobu nejméně 30 dní;II.1.4 po dobu 30 dní po odběru, anebo v případě čerstvých embryí až do dne jejich odeslání do Unie, byla embrya určená pro vývoz skladována v prostorách nacházejících se ve středu oblasti o poloměru nejméně 10 km, v níž se podle úředních zjištění nevyskytl žádný případ slintavky a kulhavky, vezikulární stomatitidy, horečky Údolí Rift nebo plicní nákazy skotu;II.1.5 byla odebrána od dárkyň, které:II.1.5.1 se během 30 dní bezprostředně před odběrem nacházely v prostorách nacházejících se ve středu oblasti o poloměru nejméně 10 km, v níž se podle úředních zjištění nevyskytl žádný případ slintavky a kulhavky, katarální horečky ovcí, epizootického hemoragického onemocnění, vezikulární stomatitidy, horečky Údolí Rift nebo plicní nákazy skotu;II.1.5.2 v den odběru nevykazovaly žádné klinické příznaky nákazy;II.1.5.3 šest měsíců bezprostředně před odběrem pobývaly na území vyvážející země v nejvýše dvou stádech:která podle úředních zjištění byla během uvedené doby prostá tuberkulózy,která podle úředních zjištění byla během uvedené doby prostá brucelózy,která byla prostá enzootické leukózy skotu nebo v nichž během předchozích třech letech žádné zvíře nevykazovalo klinické příznaky enzootické leukózy skotu,v nichž žádné zvíře v předchozích 12 měsících nevykazovalo klinické příznaky infekční rhinotracheitidy skotu/infekční pustulární vulvovaginitidy.II.1.6 Embrya určená pro vývoz byla počata prostřednictvím umělé inseminace za použití spermatu pocházejícího z inseminačních stanic nebo ze středisek pro skladování spermatu schválených pro účely odběru, zpracování a/nebo skladování spermatu příslušným orgánem třetí země nebo její části uvedených v příloze I prováděcího rozhodnutí Komise 2011/630/EU (4) nebo příslušným orgánem členského státu.](./../../../../resource.html?uri=celex:02012D0414-20130101.CES.xhtml.L_2012194CS.01001601.tif.jpg)

PŘÍLOHA III
Vzorové veterinární osvědčení pro dovoz embryí skotu vyprodukovaných in vitro, která byla počata za použití spermatu splňujícího požadavky Směrnice Rady 88/407/EHS

 nebo [II.1.1.2 nebyla po dobu 12 měsíců bezprostředně před produkcí embryí prostá slintavky a kulhavky a/nebo prováděla v uvedeném období očkování proti slintavce a kulhavce, aembrya byla vyprodukována bez penetrace zona pellucida,embrya byla nejméně po dobu 30 dní bezprostředně po produkci skladována ve schválených podmínkách,dárkyně pocházejí z hospodářství, ve kterých nebylo žádné zvíře očkováno proti slintavce a kulhavce v období 30 dní před odběrem a žádné zvíře vnímavých druhů nevykazovalo klinické příznaky slintavky a kulhavky v období 30 dní před odběrem oocytů a nejméně 30 dní po odběru oocytů;];II.1.2 byla vyprodukována týmem pro produkci embryí (3), který:byl schválen v souladu s přílohou A kapitolou I směrnice 89/556/EHS,provedl produkci, ošetření, skladování a přepravu v souladu s přílohou A kapitolou II směrnice 89/556/EHS,je nejméně dvakrát ročně kontrolován úředním veterinárním lékařem.II.2 Oocyty použité při produkci embryí určených pro vývoz byly odebrány v prostorách nacházejících se ve středu oblasti o poloměru nejméně 10 km, v níž se podle úředních zjištění nevyskytl žádný případ slintavky a kulhavky, epizootického hemoragického onemocnění, vezikulární stomatitidy, horečky Údolí Rift nebo plicní nákazy skotu, a to během 30 dní bezprostředně před odběrem a až do dne odeslání do Unie v případě čerstvých embryí, nebo během 30 dní po odběru v případě embryí, která byla v souladu s bodem II.1.1.2 povinně skladována po dobu nejméně 30 dní.II.3 Po dobu 30 dní po odběru, anebo v případě čerstvých embryí až do dne odeslání, byla embrya určená pro vývoz skladována v prostorách nacházejících se ve středu oblasti o poloměru nejméně 10 km, v níž se podle úředních zjištění nevyskytl žádný případ slintavky a kulhavky, vezikulární stomatitidy, horečky Údolí Rift nebo plicní nákazy skotu.II.4 Dárkyně oocytů použitých k produkci embryí určených pro vývoz:II.4.1 se během 30 dní bezprostředně před odběrem oocytů nacházely v prostorách nacházejících se ve středu oblasti o poloměru nejméně 10 km, v níž se podle úředních zjištění nevyskytl žádný případ slintavky a kulhavky, katarální horečky ovcí, epizootického hemoragického onemocnění, vezikulární stomatitidy, horečky Údolí Rift nebo plicní nákazy skotu;II.4.2 v den odběru nevykazovaly žádné klinické příznaky nákazy;II.4.3 šest měsíců bezprostředně před odběrem pobývaly na území vyvážející země v nejvýše dvou stádech:která podle úředních zjištění byla během uvedené doby prostá tuberkulózy,která podle úředních zjištění byla během uvedené doby prostá brucelózy,která byla prostá enzootické leukózy skotu nebo v nichž v předchozích třech letech žádné zvíře nevykazovalo klinické příznaky enzootické leukózy skotu,v nichž žádné zvíře v předchozích 12 měsících nevykazovalo klinické příznaky infekční rhinotracheitidy skotu/infekční pustulární vulvovaginitidy;(1) buď [II.4.4 byly drženy v zemi nebo oblasti prosté viru katarální horečky ovcí po dobu nejméně 60 dní před odběrem a během odběru oocytů;]](./../../../../resource.html?uri=celex:02012D0414-20130101.CES.xhtml.CL2012D0414CS0000010.0001.tif.jpg)
 nebo [II.4.4 podstoupily mezi 21 a 60 dny po odběru s negativními výsledky sérologické vyšetření ke zjištění protilátek proti skupině viru katarální horečky ovcí, provedené podle Příručky norem pro diagnostické testy a očkovací látky pro suchozemská zvířata Světové organizace pro zdraví zvířat, a embrya byla skladována nejméně po dobu 30 dní;](1) nebo [II.4.4 podstoupily s negativními výsledky vyšetření na určení původce, provedené podle Příručky norem pro diagnostické testy a očkovací látky pro suchozemská zvířata Světové organizace pro zdraví zvířat na vzorku krve odebrané v den odběru nebo v den porážky, přičemž ve druhém případě byla embrya vyprodukována bez penetrace zona pellucida.]II.5 Embrya určená pro vývoz byla počata prostřednictvím oplodnění in vitro za použití spermatu pocházejícího z inseminačních stanic nebo ze středisek pro skladování spermatu (4):(1) buď [II.5.1 schválených v souladu s čl. 5 odst. 1 směrnice 88/407/EHS a nacházejících se v členském státě Evropské unie, přičemž sperma splňuje požadavky směrnice 88/407/EHS.](1) nebo [II.5.1 schválených v souladu s čl. 9 odst. 1 směrnice 88/407/EHS a nacházejících se ve třetí zemi nebo její části uvedené v příloze I prováděcího rozhodnutí Komise 2011/630/EU, přičemž sperma splňuje požadavky přílohy II části 1 oddíle A uvedeného rozhodnutí.]PoznámkyČást I:Kolonka I.6 Osoba odpovědná za zásilku v EU: tuto kolonku je třeba vyplnit pouze tehdy, jedná-li se o osvědčení pro zboží určené pro tranzit.Kolonka I.11 Místo původu označuje tým pro odběr embryí, odkud jsou embrya odesílána do Unie a který je v souladu s čl. 8 odst. 2 směrnice 89/556/EHS uveden v seznamu na internetových stránkách Komise:http://ec.europa.eu/food/animal/semen_ova/bovine/ova_embryos_en.htm.Kolonka I.22 Počet balení musí odpovídat počtu kontejnerů.Kolonka I.23 Uvede se označení kontejneru a číslo plomby.Kolonka I.26 Vyplňte podle toho, jedná-li se o osvědčení pro tranzit nebo pro dovoz.Kolonka I.27 Vyplňte podle toho, jedná-li se o osvědčení pro tranzit nebo pro dovoz.Kolonka I.28 Druh: Uveďte podle situace „Bos taurus“, „Bison bison“ nebo „Bubalus bubalis“.Kategorie: Uveďte „embrya získaná in vivo“.Totožnost dárkyně musí odpovídat úřední identifikaci zvířete.Totožnost dárce musí odpovídat úřední identifikaci zvířete.Datum zmrazení musí být uvedeno v následujícím tvaru: dd/mm/rr.Číslo schválení týmu: musí odpovídat týmu pro odběr embryí, který embrya odebral, ošetřil a skladoval a který je v souladu s čl. 8 odst. 2 směrnice 89/556/EHS uveden v seznamu na internetových stránkách Komise: http://ec.europa.eu/food/animal/semen_ova/bovine/ova_embryos_en.htmČást II:(1) Nehodící se škrtněte.(2) Pouze třetí země uvedené v příloze I rozhodnutí 2006/168/ES.(3) Pouze týmy pro produkci embryí, které jsou v souladu s čl. 8 odst. 2 směrnice 89/556/EHS uvedeny v seznamu na internetových stránkách Komise: http://ec.europa.eu/food/animal/semen_ova/bovine/ova_embryos_en.htm(4) Pouze inseminační stanice, které jsou v souladu s čl. 5 odst. 2 a čl. 9 odst. 2 směrnice 88/407/EHS uvedeny v seznamu na internetových stránkách Komise:http://ec.europa.eu/food/animal/approved_establishments/establishments_vet_field_en.htm;http://ec.europa.eu/food/animal/semen_ova/bovine/index_en.htm.Barva podpisu a razítka se musí lišit od barvy tisku.](./../../../../resource.html?uri=celex:02012D0414-20130101.CES.xhtml.CL2012D0414CS0000010.0002.tif.jpg)

PŘÍLOHA IV
Vzorové veterinární osvědčení pro dovoz embryí skotu vyprodukovaných in vitro, která byla počata za použití spermatu pocházejícího z inseminačních stanic nebo středisek pro skladování spermatu schválených příslušným orgánem vyvážející země
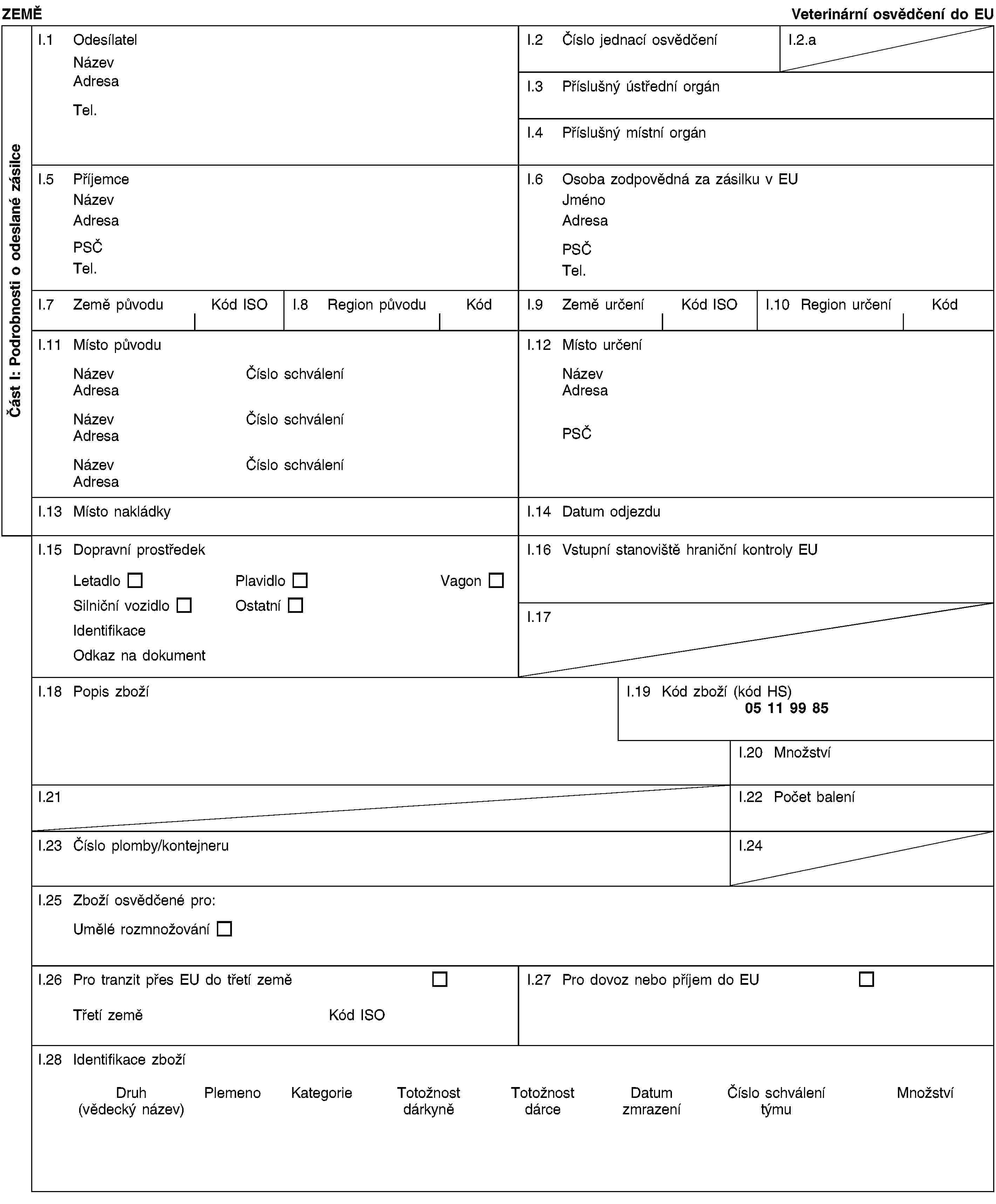
 nebo [II.1.1.2 nebyla po dobu 12 měsíců bezprostředně před produkcí embryí prostá slintavky a kulhavky a/nebo prováděla v uvedeném období očkování proti slintavce a kulhavce, aembrya byla vyprodukována bez penetrace zona pellucida,embrya byla nejméně po dobu 30 dní bezprostředně po produkci skladována ve schválených podmínkách,dárkyně pocházejí z hospodářství, ve kterých nebylo žádné zvíře očkováno proti slintavce a kulhavce v období 30 dní před odběrem a žádné zvíře vnímavých druhů nevykazovalo klinické příznaky slintavky a kulhavky v období 30 dní před odběrem oocytů a nejméně 30 dní po odběru oocytů;]II.1.2 byla vyprodukována týmem pro produkci embryí (3), který:byl schválen v souladu s přílohou A kapitolou I směrnice 89/556/EHS,provedl produkci, ošetření, skladování a přepravu embryí v souladu s přílohou A kapitolou II směrnice 89/556/EHS,je nejméně dvakrát ročně kontrolován úředním veterinárním lékařem.II.2 Oocyty použité při produkci embryí určených pro vývoz byly odebrány v prostorách nacházejících se ve středu oblasti o poloměru nejméně 10 km, v níž se podle úředních zjištění nevyskytl žádný případ slintavky a kulhavky, epizootického hemoragického onemocnění, vezikulární stomatitidy, horečky Údolí Rift nebo plicní nákazy skotu, a to během 30 dní bezprostředně před odběrem a až do dne odeslání do Unie v případě čerstvých embryí, nebo během 30 dní po odběru v případě embryí, která byla v souladu s bodem II.2.2 povinně skladována po dobu nejméně 30 dní.II.3 Po dobu 30 dní po odběru, anebo v případě čerstvých embryí až do dne odeslání, byla embrya určená pro vývoz skladována v prostorách nacházejících se ve středu oblasti o poloměru nejméně 10 km, v níž se podle úředních zjištění nevyskytl žádný případ slintavky a kulhavky, vezikulární stomatitidy, horečky Údolí Rift nebo plicní nákazy skotu.II.4 Dárkyně oocytů použitých k produkci embryí určených pro vývoz:II.4.1 se během 30 dní bezprostředně před odběrem oocytů nacházely v prostorách, kde se v okruhu nejméně 10 km podle úředních zjištění nevyskytl žádný případ slintavky a kulhavky, katarální horečky ovcí, epizootického hemoragického onemocnění, vezikulární stomatitidy, horečky Údolí Rift nebo plicní nákazy skotu;II.4.2 v den odběru nevykazovaly žádné klinické příznaky nákazy;II.4.3 šest měsíců bezprostředně před odběrem pobývaly na území vyvážející země v nejvýše dvou stádech:která podle úředních zjištění byla během uvedené doby prostá tuberkulózy,která podle úředních zjištění byla během uvedené doby prostá brucelózy,která byla prostá enzootické leukózy skotu, nebo v nichž v předchozích třech letech žádné zvíře nevykazovalo klinické příznaky enzootické leukózy skotu,v nichž žádné zvíře v předchozích 12 měsících nevykazovalo klinické příznaky infekční rhinotracheitidy skotu/infekční pustulární vulvovaginitidy;(1) buď [II.4.4 byly drženy v zemi nebo oblasti prosté viru katarální horečky ovcí po dobu nejméně 60 dní před odběrem a během odběru oocytů;]](./../../../../resource.html?uri=celex:02012D0414-20130101.CES.xhtml.CL2012D0414CS0000010.0003.tif.jpg)
 nebo [II.4.4 podstoupily mezi 21 a 60 dny po odběru s negativními výsledky sérologické vyšetření ke zjištění protilátek proti skupině viru katarální horečky ovcí, provedené podle Příručky norem pro diagnostické testy a očkovací látky pro suchozemská zvířata Světové organizace pro zdraví zvířat a embrya byla skladována nejméně po dobu 30 dní;](1) nebo [II.4.4 podstoupily s negativními výsledky vyšetření na určení původce, provedené podle Příručky norem pro diagnostické testy a očkovací látky pro suchozemská zvířata Světové organizace pro zdraví zvířat na vzorku krve odebrané v den odběru nebo v den porážky, přičemž ve druhém případě byla embrya vyprodukována bez penetrace zona pellucida.]II.5 Embrya určená pro vývoz byla počata prostřednictvím oplodnění in vitro za použití spermatu pocházejícího z inseminačních stanic nebo ze středisek pro skladování spermatu schválených pro účely odběru, zpracování a/nebo skladování příslušným orgánem třetí země nebo její části uvedených v příloze I prováděcího rozhodnutí Komise 2011/630/EU (4) nebo příslušným orgánem členského státu.PoznámkyIV souladu s čl. 3 písm. a) směrnice 89/556/EHS nemohou být embrya skotu vyprodukovaná in vitro za použití spermatu pocházejícího z inseminačních stanic nebo středisek pro skladování spermatu schválených vyvážející zemí a dovezená za podmínek stanovených v tomto osvědčení předmětem obchodu uvnitř Unie.Část I:Kolonka I.6 Osoba odpovědná za zásilku v EU: tuto kolonku je třeba vyplnit pouze tehdy, jedná-li se o osvědčení pro zboží určené pro tranzit.Kolonka I.11 Místo původu označuje tým pro odběr embryí, odkud jsou embrya odesílána do Unie a který je v souladu s čl. 8 odst. 2 směrnice 89/556/EHS uveden v seznamu na internetových stránkách Komise:http://ec.europa.eu/food/animal/semen_ova/bovine/ova_embryos_en.htm.Kolonka I.22 Počet balení musí odpovídat počtu kontejnerů.Kolonka I.23 Uvede se označení kontejneru a číslo plomby.Kolonka I.26 Vyplňte podle toho, jedná-li se o osvědčení pro tranzit nebo pro dovoz.Kolonka I.27 Vyplňte podle toho, jedná-li se o osvědčení pro tranzit nebo pro dovoz.Kolonka I.28 Druh: Uveďte podle situace „Bos taurus“, „Bison bison“ nebo „Bubalus bubalis“.Kategorie: Uveďte „embrya vyprodukovaná in vivo.Totožnost dárkyně musí odpovídat úřední identifikaci zvířete.Totožnost dárce musí odpovídat úřední identifikaci zvířete.Datum zmrazení musí být uvedeno v následujícím tvaru: dd/mm/rr.Číslo schválení týmu: musí odpovídat týmu pro produkci embryí, který embrya vyprodukoval, ošetřil a skladoval a který je v souladu s čl. 8 odst. 2 směrnice 89/556/EHS uveden v seznamu na internetových stránkách Komise: http://ec.europa.eu/food/animal/semen_ova/bovine/ova_embryos_en.htm.Část II:(1) Nehodící se škrtněte.(2) Pouze třetí země uvedené v příloze I rozhodnutí 2006/168/ES.(3) Pouze týmy pro produkci embryí, které jsou v souladu s čl. 8 odst. 2 směrnice 89/556/EHS uvedeny v seznamu na internetových stránkách Komise: http://ec.europa.eu/food/animal/semen_ova/bovine/ova_embryos_en.htm.(4) Pouze třetí země uvedené v příloze I prováděcího rozhodnutí 2011/630/EU.Barva podpisu a razítka se musí lišit od barvy tisku.](./../../../../resource.html?uri=celex:02012D0414-20130101.CES.xhtml.CL2012D0414CS0000010.0004.tif.jpg)

( 1 ) Úř. věst. L 302, 19.10.1989, s. 1.
( 2 ) Úř. věst. L 57, 28.2.2006, s. 19.
( 3 ) Úř. věst. L 114, 30.4.2002, s. 1.
( 4 ) Úř. věst. L 22, 25.1.2003, s. 38.
( 5 ) Úř. věst. L 57, 26.2.1997, s. 5.
( 6 ) Úř. věst. L 57, 26.2.1997, s. 4.
( 7 ) Úř. věst. L 104, 21.4.2007, s. 37.