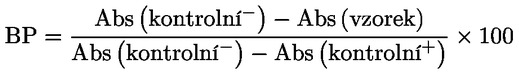(EU) 2016/1840Prováděcí rozhodnutí Komise (EU) 2016/1840 ze dne 14. října 2016, kterým se mění příloha IV směrnice Rady 2009/156/ES, pokud jde o diagnostické metody moru koní (oznámeno pod číslem C(2016) 6509) (Text s významem pro EHP)
| Publikováno: | Úř. věst. L 280, 18.10.2016, s. 33-40 | Druh předpisu: | Prováděcí rozhodnutí |
| Přijato: | 14. října 2016 | Autor předpisu: | Evropská komise |
| Platnost od: | 17. října 2016 | Nabývá účinnosti: | 17. října 2016 |
| Platnost předpisu: | Ano | Pozbývá platnosti: | |
Text předpisu s celou hlavičkou je dostupný pouze pro registrované uživatele.
PROVÁDĚCÍ ROZHODNUTÍ KOMISE (EU) 2016/1840
ze dne 14. října 2016,
kterým se mění příloha IV směrnice Rady 2009/156/ES, pokud jde o diagnostické metody moru koní
(oznámeno pod číslem C(2016) 6509)
(Text s významem pro EHP)
EVROPSKÁ KOMISE,
s ohledem na Smlouvu o fungování Evropské unie,
s ohledem na směrnici Rady 2009/156/ES ze dne 30. listopadu 2009 o veterinárních pravidlech pro přesun koňovitých a jejich dovoz ze třetích zemí (1), a zejména na článek 20 uvedené směrnice,
vzhledem k těmto důvodům:
|
(1) |
Příloha IV směrnice 2009/156/ES stanoví diagnostické metody ke zjištění moru koní, které mají být v případě potřeby použity k testování koňovitých před jejich přesunem v rámci Unie nebo dovozem ze zemí, které nejsou členem EU. |
|
(2) |
Od přijetí směrnice 2009/156/ES došlo k rozšíření kapacit laboratoří pro provádění vyspělých, vysoce citlivých a účinných testů ke stanovení diagnózy moru koní. Souběžně s tím došlo k úpravě kapitoly Příručky norem pro diagnostické testy a očkovací látky pro suchozemská zvířata Světové organizace pro zdraví zvířat (OIE) (2) upravující diagnostiku moru koní, která tak reaguje na tento vývoj. |
|
(3) |
V rámci svého pracovního programu v roce 2014 vydala referenční laboratoř Evropské unie pro mor koní (3) zprávu o technickém posouzení diagnostických metod popsaných v příloze IV směrnice 2009/156/ES. Posouzení předložené Komisi v květnu 2015 dospělo k závěru, že kompetitivní enzymový imunotest (enzyme-linked immunosorbent assay, ELISA) již není k dispozici, že nepřímý test ELISA se běžně nepoužívá, ale lze jej na vyžádání dodat ve lhůtě 4 až 6 měsíců, a že blokující test ELISA je komerčně dostupný a běžně se používá k analýze vzorků při testech odborné způsobilosti organizovaných referenční laboratoří Evropské unie pro mor koní. |
|
(4) |
Uvedená zpráva rovněž zdůrazňuje, že metody rozpoznávání nukleové kyseliny za použití polymerázové řetězové reakce s reverzní transkripcí (RT-PCR) přinášejí oproti sérologickým diagnostickým metodám výhody, neboť umožňují nákazu stanovit v rané fázi infekce. Většina národních referenčních laboratoří členských států Evropské unie navíc používá metody RT-PCR v reálném čase, včetně diagnostikování moru koní, přičemž testy odborné způsobilosti prováděné v letech 2009 až 2014 prokázaly, že uvedené metody jsou k tomuto účelu vhodné. Ve zprávě se také uvádí, že mimo Unii existuje řada referenčních laboratoří OIE a dalších laboratoří kvalifikovaných k diagnostikování moru koní, které k detekci genomu moru koní zavedly alespoň jednu metodu RT-PCR v reálném čase. |
|
(5) |
Ve dnech 24.–25. listopadu 2015 vzešlo ze společné pracovní schůzky referenčních laboratoří Evropské unie pro mor koní / katarální horečku ovcí a národních referenčních laboratoří uspořádané v Ascotu ve Spojeném království doporučení zahrnout do přílohy IV směrnice 2009/156/ES pro detekci viru moru koní metody polymerázové řetězové reakce (PCR) s reverzní transkripcí v reálném čase (RRT). |
|
(6) |
Ačkoliv jsou všechny dostupné metody RT-PCR v reálném čase k detekci genomu moru koní dostatečně citlivé, laboratoře nejvíce využívají postup popsaný v Agüero a kol. (2008) (4). Metoda popsaná v Guthrie a kol. (2013) (5) byla navržena s konkrétním cílem, a sice zajistit, aby koně z rizikových oblastí s výskytem moru koní bylo možné bezpečně převážet po uplynutí minimální doby karantény stanovené v Kodexu zdraví suchozemských živočichů (6) OIE. |
|
(7) |
Z těchto důvodů je vhodné do přílohy IV směrnice 2009/156/ES zařadit metody k identifikaci původce a detekci protilátky jako komplementární metody pro rychlou diagnostiku moru koní. |
|
(8) |
Příloha IV směrnice 2009/156/ES by tedy měla být změněna tak, že bude vypuštěn kompetitivní test ELISA a aktualizují se postupy pro nepřímé a blokující testy ELISA v souladu s kapitolou 2.5.1 Příručky pro diagnostické testy a očkovací látky pro suchozemská zvířata OIE, vydání z roku 2016 vycházející z verze přijaté Světovým shromážděním delegátů OIE v květnu 2012 (7). Zároveň by měly být do příslušné přílohy přidány postupy RT-PCR v reálném čase popsané v Agüero a kol. (2008) a Guthrie a kol. (2013), aby byly tyto testy identifikace původce přístupné pro účely testování před přesunem. |
|
(9) |
Směrnice 2009/156/ES by proto měla být odpovídajícím způsobem změněna. |
|
(10) |
Opatření přijatá v tomto rozhodnutí jsou v souladu se stanoviskem Stálého výboru pro rostliny, zvířata, potraviny a krmiva, |
PŘIJALA TOTO ROZHODNUTÍ:
Článek 1
Příloha IV směrnice 2009/156/ES se nahrazuje zněním uvedeným v příloze tohoto rozhodnutí.
Článek 2
Toto rozhodnutí je určeno členským státům.
V Bruselu dne 14. října 2016.
Za Komisi
Vytenis ANDRIUKAITIS
člen Komise
(1) Úř. věst. L 192, 23.7.2010, s. 1.
(2) http://www.oie.int/fileadmin/Home/eng/Health_standards/tahm/2.05.01_AHS.pdf
(3) Směrnice Rady 92/35/EHS ze dne 29. dubna 1992, kterou se stanoví pravidla a opatření pro tlumení moru koní (Úř. věst. L 157, 10.6.1992, s. 19).
(4) Agüero M., Gomez-Tejedor C., Angeles Cubillo M., Rubio C., Romero E. a Jimenez-Clavero A. (2008). Real-time fluorogenic reverse transcription polymerase chain reaction assay for detection of African horse sickness virus. J. Vet. Diagn. Invest., 20, 325–328.
(5) Guthrie AJ, MacLachlan NJ, Joone C, Lourens CW, Weyer CT, Quan M, Monyai MS, Gardner IA. Diagnostic accuracy of a duplex real-time reverse transcription quantitative PCR assay for detection of African horse sickness virus. Journal of Virological Methods. 2013;189(1):30–35.
(6) http://www.oie.int/fileadmin/Home/eng/Health_standards/tahc/current/chapitre_ahs.pdf
(7) Viz poznámka pod čarou 2.
PŘÍLOHA
„PŘÍLOHA IV
MOR KONÍ
DIAGNOSTIKA
ČÁST A
Sérologické testy
Na základě kapitoly 2.5.1 oddílu B bodu 2 Příručky norem pro diagnostické testy a očkovací látky pro suchozemská zvířata vydané v roce 2016 a přijaté Světovým shromážděním delegátů OIE v květnu 2012 využívá sérologická metoda zde popsaná enzymovou imunoanalýzu s enzymem vázaným na imunosorbent (enzyme-linked immunosorbent assays, ELISA).
VP7 je hlavní imunodominantní antigenní virový protein viru moru koní (AHSV) a je obsažený ve všech devíti sérotypech AHSV. Bylo prokázáno, že rekombinantní proteiny AHSV-VP7 jsou stabilní, neškodné a vhodné pro použití jako antigeny v postupech využívajících ELISA pro stanovení protilátek proti AHSV a poskytují vysoký stupeň senzitivity a specificity (Laviada et al., 1992b (1); Maree and Paweska, 2005). Nepřímý test ELISA a blokující test ELISA jsou dva testy AHS-VP7 ELISA, které jsou vhodné pro sérologickou diagnózu moru koní.
1. Nepřímý test ELISA pro zjištění protilátek proti viru moru koní (AHSV)
Jako konjugát využívá tato metoda antikoňský gama-globulin konjugovaný s křenovou peroxidázou reagující se sérem koní, mezků a oslů. Metoda popsaná v publikaci Maree & Paweska (2005) (2) využívá jako konjugát protein G, který rovněž reaguje se sérem zeber.
Antigen lze získat ve středisku Centro de Investigación en Sanidad Animal (CISA) ve lhůtě 4 až 6 měsíců od zaslání žádosti.
1.1. Postup testu
1.1.1. Pevná fáze
|
1.1.1.1. |
Destičky ELISA se pokryjí rekombinantem AHSV-4 VP7 rozpuštěným v karbonátovém/bikarbonátovém pufru, pH 9,6. Destičky se inkubují přes noc při teplotě 4 °C. |
|
1.1.1.2. |
Destičky se pětkrát propláchnou destilovanou vodou obsahující 0,01 % (obj.) látky Tween 20 (mycí roztok). Destičky se jemně poklepou savým materiálem, aby byl odstraněn veškerý zbytkový mycí roztok. |
|
1.1.1.3. |
Destičky se blokují fosfátovým pufrem (PBS) pH 7,2 + 5 % (hmot./obj.) roztokem odstředěného mléka (Nestlé Dry Skim MilkTM), 200 μl/jamka, 1 hodinu při teplotě 37 °C. |
|
1.1.1.4. |
Blokující pufr se odstraní a destičky se jemně poklepou savým materiálem. |
1.1.2. Testované vzorky
|
1.1.2.1. |
Vzorky séra, které mají být testovány, a pozitivní a negativní kontrolní sérum se rozpustí v poměru 1 ku 25 v PBS + 5 % (hmot./obj.) roztoku odstředěného mléka + 0,05 % (obj.) látky Tween 20, 100 μl na jamku. Inkubují se 1 hodinu při teplotě 37 °C. Pro titraci se připraví dvojitá série roztoků od 1 ku 25 (100 μl/jamka), jedno sérum v každém sloupci destičky, a totéž se provede s pozitivními a negativními kontrolními vzorky. Vzorky se inkubují 1 hodinu při teplotě 37 °C. |
|
1.1.2.2. |
Destičky se pětkrát propláchnou destilovanou vodou obsahující 0,01 % (obj.) látky Tween 20 (mycí roztok). Destičky se jemně poklepou savým materiálem, aby byl odstraněn veškerý zbytkový mycí roztok. |
1.1.3. Konjugát
|
1.1.3.1. |
Antikoňský gama-globulin konjugovaný s křenovou peroxidázou (HRP) rozředěný v PBS + 5 % mléka + 0,05 % látky Tween 20, pH 7,2 se rozdělí v množstvích 100 μl/jamka. Inkubuje se 1 hodinu při teplotě 37 °C. |
|
1.1.3.2. |
Destičky se pětkrát propláchnou destilovanou vodou obsahující 0,01 % (obj.) látky Tween 20 (mycí roztok). Destičky se jemně poklepou savým materiálem, aby byl odstraněn veškerý zbytkový mycí roztok. |
1.1.4. Chromogen/substrát
|
1.1.4.1. |
Přidá se 200 μl/jamka roztoku chromogenu/substrátu (10 ml 80,6 mM DMAB (dimethylaminobenzaldehyd) + 10 ml 1,56 mM MBTH (3-methyl-2-benzothiazolinon-hydrazon-hydrochlorid) + 5 μl H2O2). Proces barvení se zastaví přidáním 50 μl 3N HH2SO4 asi po 5 až 10 minutách (předtím, než se začnou zbarvovat negativní kontrolní vzorky). Mohou být použity také další chromogeny, např. ABTS (2,2′-azino-bis-[3-ethylbenzothiazolin-6-kyselina sulfonová]), TMB (tetra-methyl benzidin) nebo OPD (orto-fenyldiamin). |
|
1.1.4.2. |
Destičky se vyhodnotí při vlnové délce 600 nm (nebo 620 nm). |
1.2. Interpretace výsledků
|
1.2.1. |
Prahová hodnota se vypočte přidáním 0,06 k hodnotě negativní kontroly (0,06 je směrodatná odchylka odvozená ze skupiny 30 negativních sér). |
|
1.2.2. |
Testované vzorky vykazující hodnoty absorpce nižší než prahová hodnota jsou považovány za negativní. |
|
1.2.3. |
Testované vzorky vykazující hodnoty absorpce vyšší než prahová hodnota +0,15 jsou považovány za pozitivní. |
|
1.2.4. |
Testované vzorky vykazující střední hodnoty absorpce jsou nejisté a k potvrzení výsledku musí být použita druhá metoda. |
2. Blokující test ELISA pro zjištění protilátek proti viru moru koní (AHSV)
Kompetitivní blokující test ELISA je zaměřen na zjištění specifických protilátek proti AHSV v séru koňovitých, tj. koňů, oslů, zeber a jejich kříženců. Tento test předchází problému se specificitou, k němuž příležitostně dochází při použití nepřímých testů ELISA.
Podstatou testu je přerušení reakce mezi rekombinantním proteinem VP7 vázaným na destičku ELISA a konjugovanou monoklonální protilátkou (Mab) specifickou na AHS-VP7. Protilátka v testovaném séru blokuje reakci mezi antigenem a Mab a v důsledku toho dojde ke zmírnění zbarvení. Protože je Mab zaměřena proti VP7, poskytuje test vysokou úroveň senzitivity a specificity.
Kompetitivní blokující test ELISA je komerčně dostupný.
2.1. Postup testu
2.1.1. Pevná fáze
|
2.1.1.1. |
Destičky ELISA se pokryjí 50–100 ng rekombinantu AHSV-4 VP7 rozpuštěného v karbonátovém/bikarbonátovém pufru, pH 9,6. Inkubují se přes noc při teplotě 4 °C. |
|
2.1.1.2. |
Destičky se třikrát propláchnou fosfátovým pufrem (PBS) 0,1× obsahujícím 0,135 M NaCl a 0,05 % (obj.) látky Tween 20 (PBST). Destičky se jemně poklepou savým materiálem, aby byl odstraněn veškerý zbytkový mycí roztok. |
2.1.2. Testované vzorky a kontrolní vzorky
|
2.1.2.1. |
Vzorky séra, které mají být testovány, a pozitivní a negativní kontrolní sérum se rozpustí v poměru 1 ku 5 v roztoku obsahujícím 0,35 M NaCl, 0,05 % (obj.) látky Tween 20 a 0,1 % Kathon, 100 μl na jamku. Inkubuje se 1 hodinu při teplotě 37 °C. Pro titraci se připraví dvojitá série roztoků testovaných sér (100 μl/jamka) od 1 ku 10 do 1 ku 280 v osmi jamkách, jedno sérum na sloupec destičky. Stejný krok se provede i s pozitivním a negativním kontrolním sérem. Inkubuje se 1 hodinu při teplotě 37 °C. |
|
2.1.2.2. |
Destičky se pětkrát propláchnou solným fosfátovým pufrem (PBS) 0,1× obsahujícím 0,135 M NaCl a 0,05 % (obj.) látky Tween 20 (PBST). Destičky se jemně poklepou savým materiálem, aby byl odstraněn veškerý zbytkový mycí roztok. |
2.1.3. Konjugát
|
2.1.3.1. |
Do každé jamky se přidá 100 μl roztoku Mab proti VP7 konjugovaného s křenovou peroxidázou. Tento roztok Mab byl předem naředěn v poměru 1/5 000–1/15 000 v roztoku stabilizátoru StabiliZyme Select® (SurModics. Reference: SZ03) 1 ku 1 v destilované vodě. Inkubuje se 30 minut při teplotě 37 °C. |
|
2.1.3.2. |
Destičky se pětkrát propláchnou solným fosfátovým pufrem (PBS) 0,1× obsahujícím 0,135 M NaCl a 0,05 % (obj.) látky Tween 20 (PBST). Destičky se jemně poklepou savým materiálem, aby byl odstraněn veškerý zbytkový mycí roztok. |
2.1.4. Chromogen/substrát
Přidá se 100 μl/jamka roztoku chromogen/substrát, tj.1 ml ABTS (2,2′-azino-bis-[3-ethylbenzothiazolin-6-kyselina sulfonová]), 5 mg/ml + 9 ml substrátového pufru (0,1 M fosfáto-citrátový pufr pH 4 obsahující 0,03 % H2O2, a inkubuje se 10 minut při pokojové teplotě. Proces barvení se zastaví přidáním 100 μl/jamka 2 % (hmot./obj.) roztoku SDS (natriumdodecylsulfát).
2.1.5. Vyhodnocení
Vzorek se vyhodnotí při vlnové délce 405 nm pomocí odečítacího zařízení pro ELISA.
2.2. Interpretace výsledků
|
2.2.1. |
Blokující procento (BP) každého vzorku se určí pomocí následujícího vzorce, kde „Abs“ znamená protilátky:
|
|
2.2.2. |
Vzorky s hodnotou BP vyšší než 50 % by měly být považovány za pozitivní na protilátky proti AHSV. |
|
2.2.3. |
Vzorky s hodnotou BP nižší než 45 % by měly být považovány za negativní na protilátky proti AHSV. |
|
2.2.4. |
Vzorky s hodnotou BP mezi 45 % a 50 % by měly být považovány za nejisté a testování je třeba provést znovu. V případě opakovaného nejistého výsledky by zvířata měla být znovu vyšetřena na základě vzorků odebraných nejdříve dva týdny po odběru vzorku, který se považoval za nejistý. |
ČÁST B
Identifikace původce
Polymerázová řetězová reakce s reverzní transkripcí v reálném čase (rRT-PCR)
Testy k identifikaci původce založené na metodách využívajících nukleovou kyselinu musí zjistit referenční kmeny u devíti virových sérotypů AHSV.
Metoda popsaná v bodě 2.1. vychází z kapitoly 2.5.1. oddílu B bodu 1.2 Příručky pro diagnostické testy a očkovací látky pro suchozemská zvířata, vydání z roku 2016 přijaté Světovým shromážděním delegátů OIE v květnu 2012.
Každá detekční metoda využívající RT-PCR používaná při testování vzorků krve nebo sleziny v souladu se směrnicí 2009/156/ES musí vykázat stejnou nebo vyšší senzitivitu jako metody popsané v bodě 2.
Inaktivovaný vir referenčních kmenů sérotypů 1 až 9 je možné získat v referenční laboratoři Evropské unie nebo referenční laboratoři OIE pro mor koní v Algete ve Španělsku.
1. Extrakce virové RNA
K zajištění dobré reakce je nezbytné ze vzorku AHSV extrahovat vysoce kvalitní RNA. Extrakci nukleových kyselin z klinických vzorků lze provést různými interními a komerčně dostupnými metodami.
Komerční sady využívají k izolaci RNA různé přístupy. Většina z nich je založena na jednom z následujících postupů:
|
— |
extrakce nukleových kyselin pomocí fenol-chloroformu, |
|
— |
adsorpce nukleových kyselin do filtračního systému, |
|
— |
adsorpce nukleových kyselin do systému magnetických kuliček. |
Níže je uveden příklad interně provedené extrakce RNA:
|
1.1. |
1 g vzorku tkáně se homogenizuje v 1 ml denaturačního roztoku (4 M guanidium thiokyanát, 25 mM citronan sodný, 0,1 M 2-merkaptoetanol, 0,5 % sarkosyl). |
|
1.2. |
Po odstředění se do supernatantu přidá 1 μg reagentu kvasinkové RNA, 0,1 ml 2 M octanu sodného pH 4, 1 ml fenolu a 0,2 ml směsi chloroformu a isoamylalkoholu (49/1). |
|
1.3. |
Suspenze se prudce protřepe a po dobu 15 minut zchladí na ledu. |
|
1.4. |
Po odstředění se RNA přítomná ve vodné fázi extrahuje fenolem, precipituje etanolem a resuspenduje ve sterilní vodě. |
2. Postup RT-PCR v reálném čase
2.1. Skupinově specifická RT-PCR v reálném čase dle Agüero a kol., 2008 (3)
Tato skupinově specifická RT-PCR v reálném čase cílí na VP7 v AHSV a dokáže detekovat všechny známé a aktuálně cirkulující sérotypy a kmeny AHSV. Uplatnění této metody přineslo v účastnících se národních referenčních laboratořích členských států Evropské unie při zkouškách odborné způsobilosti každoročně organizovaných referenční laboratoří Evropské unie v období 2009–2015 velmi dobré výsledky. V mezinárodním kruhovém testu provedeném v roce 2015 v rámci sítě referenčních laboratoří OIE se tento protokol rovněž umístil na předních místech.
Sekvenování primeru a sondy k detekci virů druhu AHSV:
|
— |
přímý primer |
5′-CCA-GTA-GGC-CAG-ATC-AAC-AG-3′ |
|
— |
reverzní primer |
5′-CTA-ATG-AAA-GCG-GTG-ACC-GT-3′ |
|
— |
sonda MGB-TaqMan |
5′-FAM-GCT-AGC-AGC-CTA-CCA-CTA-MGB-3′ |
|
2.1.1. |
Koncentrace primeru se naředí na pracovní koncentraci 8 μM (dále jen „pracovní primer 8 μM“) a sonda se naředí na pracovní koncentraci 50 μM (dále jen „pracovní roztok sondy 50 μM“). Navrhne se uspořádání testovací destičky a nahraje se do softwaru přístroje k provedení metody PCR v reálném čase. S využitím plánu uspořádání se přidá 2,5 μl každého pracovního primeru 8 μM do každé jamky, která bude obsahovat vzorky RNA, pozitivní a/nebo negativní kontrolní vzorky (konečná koncentrace primeru bude 1 μM v 20 μl roztoku RT-PCR mix). Destička se uchovává na ledu. |
|
2.1.2. |
2 μl izolované RNA (testované vzorky a pozitivní kontrolní vzorky), nebo 2 μl vody bez ribonukleáz pro negativní kontrolní vzorky se smíchají s přímým a reverzním primerem. Směs se ohřevem na 95 °C po dobu 5 minut denaturuje a následně je rychle zchlazena na ledu po dobu alespoň 5 minut. |
|
2.1.3. |
Podle pokynů výrobce se připraví roztok master mix k provedení jednokrokové RT-PCR v reálném čase v objemu dostatečném pro počet testovaných vzorků. 0,1 μl pracovního roztoku sondy o 50 μM se přidá do každé jamky obsahující vzorky RNA (konečná koncentrace sondy bude 0,25 μM v každé jamce obsahující vzorky RNA. 13 μl roztoku master mix k provedení jednokrokové RT-PCR v reálném čase se rozdělí do každé jamky na destičce PCR obsahující denaturované primery a RNA. |
|
2.1.4. |
Destička se umístí do termocykleru v reálném čase naprogramovaného na reverzní transkripci a detekci amplifikace/fluorescence cDNA. Podmínky amplifikace zahrnují první krok reverzní transkripce při 48 °C po 25 minut, následovaný 10 minutami při 95 °C („horký start“) a 40 cykly po 15 sekundách při 95 °C, po 35 sekundách při 55 °C a po 30 sekundách při 72 °C (nebo 40 cyklů při 97 °C po 2 sekundách a při 55 °C po 30 sekundách při použití reakčních činidel a termocykleru určených pro rychlé reakce). Údaje o fluorescenci se získají na konci kroku při 55 °C. |
|
2.1.5. |
Stanovení se nepovažuje za validní, jsou-li výsledkem atypické amplifikační křivky, a musí být provedeno znovu. Vzorky jsou považovány za pozitivní, pokud je hodnota Ct (číslo cyklu, při němž fluorescence vzniklá při reakci překročí prahovou hodnotu fluorescence) nižší nebo se rovná definované prahové hodnotě Ct (35) během 40 cyklů PCR (Ct ≤ 35). Vzorky jsou považovány za nejisté, pokud je hodnota Ct vyšší než definovaná prahová hodnota Ct (35) během 40 cyklů PCR (Ct ≥ 35). Vzorky jsou považovány za negativní, pokud získaná horizontální křivka amplifikace během 40 cyklů PCR nepřekročí prahovou linii. |
2.2. Skupinově specifická RT-PCR v reálném čase dle Guthrie a kol., 2013 (4)
RT-PCR v reálném čase využívající sondy fluorescenčního rezonančního přenosu energie (FRET) k detekci nukleové kyseliny v AHSV.
Popsané stanovení obsahu AHSV RT-PCR bylo navrženo pomocí sekvencí ze širokého spektra v současnosti cirkulujících kmenů AHSV (Quan a kol., 2010 (5)). Rovněž zahrnuje chráněnou syntetickou externí kontrolu stanovení obsahu k ověření řádného fungování komponent pro stanovení obsahu.
Soupravy pro jednokrokovou PCR v reálném čase jsou komerčně k dispozici. Níže jsou uvedeny některé základní kroky tak, jak je popsal Guthrie a kol. (2013), které lze upravit v závislosti podle místních specifik nebo specifik jednotlivých případů, použitých soupravách a dostupném vybavení.
Sekvenování primeru a sondy k detekci virů druhu AHSV:
|
— |
přímý primer |
5′-AGA-GCT-CTT-GTG-CTA-GCA-GCC-T-3′ |
|
— |
reverzní primer |
5′-GAA-CCG-ACG-CGA-CAC-TAA-TGA-3′ |
|
— |
sonda MGB-TaqMan |
5′-FAM-TGC-ACG-GTC-ACC-GCT-MGB-3′ |
|
2.2.1. |
Roztoky primeru a sondy se připraví v 25 × násobné koncentraci při 5 μΜ v případě přímého a reverzního primeru a 3 μΜ v případě sondy. Navrhne se uspořádání testovací destičky a nahraje se do softwaru přístroje k provedení metody PCR v reálném čase. S využitím plánu uspořádání se přidá 5 μl vzorků RNA, včetně testovacích vzorků a pozitivních i negativních kontrolních vzorků, do příslušných jamek na destičce. |
|
2.2.2. |
RNA se denaturuje ohřevem na 95 °C po dobu 5 minut a následně se rychle zchladí na ledu po dobu alespoň 3 minut. |
|
2.2.3. |
Podle pokynů výrobce se připraví roztok master mix k provedení jednokrokové RT-PCR v reálném čase v objemu dostatečném pro počet testovaných vzorků. 1 μl 25 × násobného roztoku směsi primeru a sondy (viz bod 2.2.1 výše) se přidá do roztoku master mix k získání konečné koncentrace v každé jamce 200 nM pro každý primer a 120 nM pro sondu. 20 μl roztoku master mix se rozdělí do každé jamky na destičce PCR obsahující denaturovanou RNA. |
|
2.2.4. |
Destička se umístí do termocykleru v reálném čase naprogramovaného na reverzní transkripci a detekci amplifikace/fluorescence cDNA dle doporučení výrobců. Podmínky amplifikace zahrnují například první krok reverzní transkripce při 48 °C po 10 minut, následovaný 10 minutami při 95 °C a 40 cykly po 15 sekundách při 95 °C a po 45 sekundách při 60 °C. |
|
2.2.5. |
Vzorky jsou považovány za pozitivní, pokud normalizovaná fluorescence stanovení obsahu AHSV RT-PCR překročí prahovou hodnotu 0,1 během 36 cyklů PCR ve všech replikacích vzorku. Vzorky jsou považovány za nejisté, pokud normalizovaná fluorescence stanovení obsahu AHSV RT-PCR překročí prahovou hodnotu 0,1 během 36 až 40 cyklů PCR v kterékoli replikaci vzorku. Vzorky jsou považovány za negativní, pokud normalizovaná fluorescence stanovení obsahu AHSV RT-PCR nepřekročila prahovou hodnotu 0,1 během 40 cyklů PCR ve všech replikacích vzorku a pokud normalizovaná fluorescence chráněné syntetické externí kontroly stanovení obsahu překročila prahovou hodnotu 0,1 během 33 cyklů PCR.“ |
(1) Laviada M.D., Roy P. and Sanchez-Vizcaino J.M (1992b). Adaptation and evaluation of an indirect ELISA and immunoblotting test for African horse sickness antibody detection. In: Bluetongue, African Horse Sickness and Related Orbiviruses: Proceedings of the Second International Symposium. Walton T.E. & Osburn B.l., Eds. CRC Press, Boca Raton, Florida, USA, 646–650.
(2) Maree S. a Paweska J.T. (2005). Preparation of recombinant African horse sickness virus VP7 antigen via a simple method and validation of a VP7-based indirect ELISA for the detection of group-specific IgG antibodies in horse sera. J. Virol. Methods, 125 (1), 55–65.
(3) Agüero M., Gomez-Tejedor C., Angeles Cubillo M., Rubio C., Romero E. a Jimenez-Clavero A. (2008). Real-time fluorogenic reverse transcription polymerase chain reaction assay for detection of African horse sickness virus. J. Vet. Diagn. Invest., 20, 325–328.
(4) Guthrie AJ, MacLachlan NJ, Joone C, Lourens CW, Weyer CT, Quan M, Monyai MS, Gardner IA. Diagnostic accuracy of a duplex real-time reverse transcription quantitative PCR assay for detection of African horse sickness virus. Journal of Virological Methods. 2013;189(1):30–5.
(5) Quan, M., Lourens, C.W., MacLachlan, N.J., Gardner, I.A., Guthrie, A.J., 2010. Development and optimisation of a duplex real-time reverse transcription quantitative PCR assay targeting the VP7 and NS2 genes of African horse sickness virus. J. Virol. Methods 167, 45–52.