(EU) 2015/566Směrnice Komise (EU) 2015/566 ze dne 8. dubna 2015 , kterou se provádí směrnice 2004/23/ES, pokud jde o postupy pro ověřování rovnocenných jakostních a bezpečnostních norem pro dovážené tkáně a buňky Text s významem pro EHP
| Publikováno: | Úř. věst. L 93, 9.4.2015, s. 56-68 | Druh předpisu: | Směrnice |
| Přijato: | 8. dubna 2015 | Autor předpisu: | Evropská komise |
| Platnost od: | 29. dubna 2015 | Nabývá účinnosti: | 29. dubna 2015 |
| Platnost předpisu: | Ano | Pozbývá platnosti: | |
Text předpisu s celou hlavičkou je dostupný pouze pro registrované uživatele.
SMĚRNICE KOMISE (EU) 2015/566
ze dne 8. dubna 2015,
kterou se provádí směrnice 2004/23/ES, pokud jde o postupy pro ověřování rovnocenných jakostních a bezpečnostních norem pro dovážené tkáně a buňky
(Text s významem pro EHP)
EVROPSKÁ KOMISE,
s ohledem na Smlouvu o fungování Evropské unie,
s ohledem na směrnici Evropského parlamentu a Rady 2004/23/ES ze dne 31. března 2004 o stanovení jakostních a bezpečnostních norem pro darování, odběr, vyšetřování, zpracování, konzervaci, skladování a distribuci lidských tkání a buněk (1), a zejména na čl. 9 odst. 4 uvedené směrnice,
vzhledem k těmto důvodům:
|
(1) |
Směrnice 2004/23/ES stanoví v zájmu zajištění vysoké úrovně ochrany lidského zdraví v Unii jakostní a bezpečnostní normy pro darování, odběr, vyšetřování, zpracování, konzervaci, skladování a distribuci všech lidských tkání a buněk určených k použití u člověka a pro darování, odběr a vyšetřování lidských tkání a buněk obsažených v přípravcích určených k použití u člověka, pokud se na tyto přípravky vztahují jiné právní předpisy Unie. |
|
(2) |
K celosvětové výměně tkání a buněk dochází ve stále větším měřítku, a směrnice 2004/23/ES proto vyžaduje, aby dovoz tkání a buněk zajišťovala tkáňová zařízení, která pro tento účel akreditovaly či jmenovaly členské státy nebo jim udělily oprávnění či povolení. Výjimky z uvedeného požadavku jsou stanoveny v čl. 9 odst. 3 směrnice 2004/23/ES, který umožňuje příslušným orgánům, aby přímo povolily dovoz určitých tkání a buněk za podmínek stanovených v článku 6 směrnice Komise 2006/17/ES (2) nebo v naléhavém případě. Tyto výjimky jsou využívány pravidelně, mimo jiné, při povolování dovozu krvetvorných kmenových buněk z kostní dřeně, periferní krve nebo pupečníkové krve, které jsou využívány při léčbě řady onemocnění ohrožujících lidský život. |
|
(3) |
Směrnice 2004/23/ES dále vyžaduje, aby členské státy a dovážející tkáňová zařízení zajistily, že dovoz tkání a buněk splňuje jakostní a bezpečnostní normy rovnocenné normám, které jsou stanoveny ve směrnici 2004/23/ES, a vyzývá ke zřízení postupů pro ověřování rovnocennosti jakostních a bezpečnostních norem pro dovoz tkání a buněk. Tyto postupy by měly být stanoveny v této směrnici, aniž jsou dotčeny právní předpisy Unie v oblasti cel. |
|
(4) |
Zejména je vhodné stanovit programy schvalování a inspekcí odrážející ověřovací proces zavedený pro činnosti související s tkáněmi a buňkami prováděné v Unii. Dále je vhodné stanovit postupy, které musí dodržovat dovážející tkáňová zařízení ve vztahu k dodavatelům ze třetích zemí. |
|
(5) |
S výjimkou dovozu, který přímo povolily příslušné orgány podle čl. 9 odst. 3 směrnice 2004/23/ES, musí veškerý dovoz tkání a buněk ze třetích zemí provádět dovážející tkáňová zařízení. V případech, kdy příslušné orgány přímo povolí dovoz podle čl. 9 odst. 3 směrnice 2004/23/ES, musí příslušné orgány zajistit, aby uvedený dovoz splňoval jakostní a bezpečnostní normy rovnocenné normám stanoveným v uvedené směrnici. |
|
(6) |
Tkáně a buňky by měly být za normálních okolností dováženy bankami tkání nebo nemocničními jednotkami, které jsou akreditovány či jmenovány nebo jim bylo uděleno oprávnění či povolení coby dovážejícím tkáňovým zařízením pro účely dovozu. Banky tkání nebo nemocniční jednotky by měly být považovány za dovážející tkáňová zařízení, pokud jsou stranou smluvního ujednání s dodavatelem ze třetí země na dovoz tkání a buněk. Jestliže je stranou smluvního ujednání s dodavatelem ze třetí země subjekt nabízející zprostředkovatelské služby s cílem usnadnit dovoz tkání a buněk, avšak nikoli pro samotný dovoz, neměl by být považován za dovážející tkáňové zařízení. Členské státy mohou tyto služby regulovat mimo oblast působnosti této směrnice. |
|
(7) |
Jsou-li stranou smluvního ujednání na dovoz tkání a buněk s dodavatelem ze třetí země jiné subjekty, jako například organizace odpovědné za použití u člověka, výrobci léčivých přípravků pro moderní terapii, lékaři v nemocnici nebo jednotlivci, měly by být považovány za dovážející tkáňové zařízení. Tyto subjekty musí splňovat požadavky této směrnice a rovněž všechna příslušná ustanovení směrnice 2004/23/ES a jejich příslušné orgány je musí akreditovat či jmenovat nebo jim musí udělit oprávnění či povolení coby dovážejícím tkáňovým zařízením pro účely dovozu. Jestliže v návaznosti na dovoz tyto subjekty také provádějí vyšetřování, zpracování, konzervaci, skladování nebo distribuci dovážených tkání a buněk, musí být rovněž akreditovány či jmenovány nebo jim musí být uděleno oprávnění nebo povolení pro účely těchto činností jejich příslušnými orgány; dále musí splňovat požadavky směrnice 2004/23/ES. Kromě toho také mohou získat tkáně a buňky pocházející ze třetích zemí od bank tkání nebo nemocničních jednotek v Unii, které jsou akreditovány či jmenovány nebo jim bylo uděleno oprávnění či povolení coby dovážejícím tkáňovým zařízením jejich příslušnými orgány. |
|
(8) |
Jestliže jsou dovážející tkáňová zařízení rovněž akreditována či jmenována nebo jim bylo uděleno oprávnění či povolení coby tkáňovým zařízením pro činnosti, které vykonávají v Unii, mohou členské státy přizpůsobit své postupy pro udělování oprávnění, inspekci a podávání zpráv, jestliže budou dodrženy postupy stanovené v této směrnici. |
|
(9) |
V zájmu snazší distribuce dovážených tkání a buněk v Unii, včetně případů přeshraniční distribuce, by příslušný orgán nebo orgány měly vydat osvědčení o akreditaci, jmenování, oprávnění nebo povolení dovážejícího tkáňového zařízení. |
|
(10) |
Významnou úlohu při ověřování, zda dovážené tkáně a buňky splňují jakostní a bezpečnostní normy, které jsou rovnocenné normám stanoveným ve směrnici 2004/23/ES, hrají inspekce. Členské státy se proto vyzývají, aby v příslušných případech rovněž prováděly inspekce u dodavatelů ze třetích zemí a aby spolupracovaly s ostatními členskými státy, do nichž mohou být dovezené tkáně a buňky distribuovány. Odpovědnost za přijetí nejvhodnějších opatření a rozhodnutí, zda je třeba u dodavatelů ze třetích zemí provádět inspekce na místě, náleží členským státům, v nichž jsou umístěna dovážející tkáňová zařízení. |
|
(11) |
Byla aktualizována pracovní příručka týkající se inspekcí pro příslušné orgány (Operational Manual for Competent Authorities on inspections), která nyní zahrnuje inspekce dovážejících tkáňových zařízení a jejich dodavatelů ze třetích zemí; při provádění inspekcí může tato příručka členským státům posloužit jako orientační dokument. |
|
(12) |
Dovážející tkáňová zařízení by měla ověřit, že tkáně a buňky, jež dovážejí do Unie, splňují jakostní a bezpečnostní normy, které jsou rovnocenné jakostním a bezpečnostním normám stanoveným ve směrnici 2004/23/ES. Klíčové prvky při zajištění, aby takové ověřování proběhlo, a zejména zajištění sledovatelnosti až k dárci a kontroly, zda byla dodržena zásada dobrovolného a neplaceného darování v souladu se směrnicí 2004/23/ES, představují písemné dohody s dodavateli ze třetích zemí a dokumentace, která má být dodána a poskytnuta příslušným orgánům. Dovážející tkáňová zařízení se rovněž vyzývají, aby u svých dodavatelů ze třetích zemí coby součást tohoto ověřovacího procesu prováděly audit. |
|
(13) |
Dovážející tkáňová zařízení by měla zajistit, že je na dovážené tkáně a buňky v souladu se směrnicí Komise 2006/86/ES (3) uplatňován jednotný evropský kód, a to buď tak, že tuto povinnost splní sama, nebo jí pověří dodavatele ze třetích zemí coby součást podmínek písemné dohody, kterou s nimi uzavřela. |
|
(14) |
Členské státy by měly mít možnost udělit v případě jednorázového dovozu výjimku z požadavků stanovených v této směrnici, pokud jde o dokumentaci a písemné dohody. Takový jednorázový dovoz by nicméně měla provádět dovážející tkáňová zařízení, jež byla akreditována či jmenována nebo jimž bylo uděleno oprávnění či povolení, a obecně by k němu nemělo docházet pravidelně nebo opakovaně od stejného dodavatele ze třetí země. Tyto výjimky by měly být omezeny na situace, kdy určitá osoba (nebo osoby) má nebo měla pro svoji budoucí potřebu ve třetí zemi uskladněny tkáně nebo buňky – jedná se zejména o případy darování reprodukčních buněk mezi partnery, darování určené k autolognímu použití nebo darování určené blízkým příbuzným – a následně si přeje sama za sebe tyto tkáně či buňky dovézt do Unie. K takovému dovozu specifického druhu tkáně nebo buňky by v případě žádného konkrétního příjemce v zásadě nemělo dojít více než jednou a jeho součástí by neměly být tkáně nebo buňky pro třetí strany. |
|
(15) |
Tato směrnice nebrání členským státům zachovat nebo zavést přísnější pravidla pro dovoz tkání a buněk, zejména v zájmu dodržování zásady dobrovolného a neplaceného darování za podmínky, že jsou splněna ustanovení Smlouvy. |
|
(16) |
Opatření stanovená touto směrnicí jsou v souladu se stanoviskem Regulativního výboru pro tkáně a buňky zřízeného podle čl. 29 odst. 3 směrnice 2004/23/ES, |
PŘIJALA TUTO SMĚRNICI:
KAPITOLA I
OBECNÁ USTANOVENÍ
Článek 1
Oblast působnosti
1. Tato směrnice se použije na dovoz do Unie:
|
a) |
lidských tkání a buněk určených k použití u člověka a |
|
b) |
přípravků získaných z lidských tkání a buněk určených k použití u člověka, pokud se na takové přípravky nevztahují jiné právní předpisy Unie. |
2. V případech, kdy jsou lidské tkáně a buňky, které mají být dovezeny, určeny výhradně k použití v přípravcích, na něž se vztahují jiné právní předpisy Unie, použije se tato směrnice pouze na jejich darování, odběr a vyšetřování, které neprobíhá v Unii, a rovněž na podporu zajištění sledovatelnosti od dárce k příjemci a naopak.
3. Tato směrnice se nepoužije na:
|
a) |
dovoz tkání a buněk uvedených v čl. 9 odst. 3 písm. a) směrnice 2004/23/ES, který je přímo povolen příslušným orgánem nebo orgány; |
|
b) |
dovoz tkání a buněk uvedených v čl. 9 odst. 3 písm. b) směrnice 2004/23/ES, který je přímo povolen v naléhavých případech; |
|
c) |
krev a krevní složky ve smyslu směrnice 2002/98/ES; |
|
d) |
orgány nebo části orgánů ve smyslu směrnice 2004/23/ES. |
Článek 2
Definice
Pro účely této směrnice se použijí tyto definice:
|
a) |
„naléhavým případem“ se rozumí jakákoli neočekávaná situace, v níž není jiná skutečná možnost nežli urychleně do Unie dovézt tkáně a buňky ze třetí země pro okamžité použití u známého příjemce nebo známých příjemců, jejichž zdraví by bez takového dovozu bylo vážně ohroženo; |
|
b) |
„dovážejícím tkáňovým zařízením“ se rozumí banka tkání nebo nemocniční jednotka či jiný subjekt zřízený v Unii, který je stranou smluvního ujednání s dodavatelem ze třetí země na dovoz do Unie tkání a buněk pocházejících ze třetí země určených k použití u člověka; |
|
c) |
„jednorázovým dovozem“ se rozumí dovoz specifického druhu tkáně nebo buňky, která je určena k osobnímu použití u konkrétního příjemce nebo příjemců, kteří jsou dovážejícímu tkáňovému zařízení a dodavateli ze třetí země známi ještě před dovozem. K takovému dovozu jakéhokoli specifického druhu tkáně nebo buňky nesmí v případě jakéhokoli konkrétního příjemce v zásadě dojít více než jednou. Za „jednorázový dovoz“ se nepovažuje dovoz od stejného dodavatele ze třetí země, k němuž dochází pravidelně nebo opakovaně; |
|
d) |
„dodavatelem ze třetí země“ se rozumí tkáňové zařízení nebo jiný subjekt zřízený ve třetí zemi, který je odpovědný za vývoz tkání a buněk do Unie, jež dodává dovážejícímu tkáňovému zařízení. Dodavatel ze třetí země smí rovněž vykonávat jednu nebo více činností, které neprobíhají v Unii, a sice darování, odběr, vyšetřování, zpracování, konzervaci, skladování nebo distribuci tkání a buněk dovezených do Unie. |
KAPITOLA II
POVINNOSTI ORGÁNŮ ČLENSKÝCH STÁTŮ
Článek 3
Akreditace, jmenování, oprávnění nebo povolení pro dovážející tkáňová zařízení
1. Aniž je dotčen čl. 1 odst. 3, zajistí členské státy, aby veškerý dovoz tkání a buněk ze třetích zemí prováděla dovážející tkáňová zařízení, která byla pro účely těchto činností akreditována či jmenována příslušným orgánem nebo orgány nebo jimž uvedený orgány či orgány udělily oprávnění či povolení.
2. Poté, co příslušný orgán nebo orgány obdržely informace stanovené v příloze I této směrnice, a poté, co ověřily, že dovážející tkáňové zařízení splňuje požadavky této směrnice, akreditují či jmenují dovážející tkáňové zařízení nebo mu udělí oprávnění či povolení na dovoz tkání a buněk a stanoví případné podmínky, například jakékoli omezení druhu tkání a buněk, které smí být dováženy, nebo dodavatele ze třetích zemí, kteří smí být využíváni. Příslušný orgán nebo orgány vydají dovážejícímu tkáňovému zařízení, které bylo akreditováno či jmenováno nebo jemuž bylo uděleno oprávnění či povolení, osvědčení stanovené v příloze II této směrnice.
3. Dovážející tkáňové zařízení neprovede žádné podstatné změny svých činností v oblasti dovozu bez předchozího písemného povolení příslušného orgánu nebo orgánů. Za podstatné změny jsou považovány zejména změny druhu dovážených tkání a buněk, činností prováděných ve třetích zemích, které mohou ovlivnit kvalitu a bezpečnost dovážených tkání a buněk, nebo změny dodavatelů ze třetích zemí. Jestliže dovážející tkáňové zařízení provede jednorázový dovoz tkání či buněk pocházejících od dodavatele ze třetí země, na kterého se nevztahuje stávající akreditace, jmenování, oprávnění nebo povolení, není tento dovoz považován za podstatnou změnu, pokud má dovážející tkáňové zařízení oprávnění na dovoz stejného druhu tkání či buněk od jiného dodavatele či dodavatelů ze třetí země.
4. Příslušný orgán nebo orgány mohou částečně nebo zcela pozastavit či zrušit akreditaci, jmenování, oprávnění nebo povolení udělené dovážejícímu tkáňovému zařízení, zejména jestliže inspekce nebo jiná kontrolní opatření prokáží, že uvedené zařízení již nesplňuje požadavky této směrnice.
Článek 4
Inspekce a jiná kontrolní opatření
1. Členské státy zajistí, aby příslušný orgán nebo orgány prováděly inspekce a jiná kontrolní opatření dovážejících tkáňových zařízení a případně jejich dodavatelů ze třetích zemí a aby dovážející tkáňová zařízení prováděla příslušné kontroly v zájmu zajištění rovnocennosti jakostních a bezpečnostních norem pro tkáně a buňky, které mají být dováženy, s normami stanovenými ve směrnici 2004/23/ES. Interval mezi inspekcemi jakéhokoli dovážejícího tkáňového zařízení nesmí být delší než dva roky.
2. Inspekce provádějí pověření zástupci příslušného orgánu nebo orgánů, kteří:
|
a) |
jsou zmocněni k inspekci dovážejících tkáňových zařízení a případně činností veškerých dodavatelů ze třetích zemí; |
|
b) |
vyhodnocují a ověřují postupy a činnosti prováděné v dovážejících tkáňových zařízeních a zařízeních dodavatelů ze třetích zemí, které jsou relevantní pro rovnocennost jakostních a bezpečnostních norem pro tkáně a buňky, jež mají být dováženy, s normami stanovenými ve směrnici 2004/23/ES; |
|
c) |
přezkoumávají veškeré dokumenty či záznamy, které jsou pro uvedené hodnocení a ověřování relevantní. |
3. Členské státy poskytnou na základě řádně odůvodněné žádosti jiného členského státu nebo Komise informace o výsledcích inspekcí a jiných kontrolních opatření ve vztahu k dovážejícím tkáňovým zařízením a dodavatelům ze třetích zemí.
4. Členské státy, do nichž jsou tkáně a buňky dováženy, zváží na základě řádně odůvodněné žádosti jiného členského státu, do něhož jsou dovezené tkáně a buňky následně distribuovány, provedení inspekcí nebo jiných kontrolních opatření pro dovážející tkáňová zařízení a činnosti veškerých dodavatelů ze třetích zemí. O případných opatřeních, která budou přijata, rozhodne členský stát, v němž se příslušné dovážející tkáňové zařízení nachází, a to na základě konzultací s členským státem, který žádost předložil.
5. Jestliže na základě uvedené žádosti dojde k inspekci na místě, dohodne se příslušný orgán nebo orgány členského státu, v němž se dovážející tkáňové zařízení nachází, s příslušným orgánem nebo orgány členského státu, který tuto žádost předložil, zda a jak se členský stát, který žádost předložil, inspekce zúčastní. Konečné rozhodnutí ohledně veškeré takové účasti přijímá členský stát, v němž se dovážející tkáňové zařízení nachází. V případě, že uvedená účast bude zamítnuta, musí být důvody pro takové rozhodnutí vysvětleny členskému státu, který žádost předložil.
KAPITOLA III
POVINNOSTI DOVÁŽEJÍCÍCH TKÁŇOVÝCH ZAŘÍZENÍ
Článek 5
Žádosti o akreditaci, jmenování, oprávnění nebo povolení pro dovážející tkáňové zařízení
1. Poté, co dovážející tkáňová zařízení přijala opatření zajišťující, že veškerý dovoz tkání a buněk splňuje jakostní a bezpečnostní normy rovnocenné normám stanoveným ve směrnici 2004/23/ES a že dovážené tkáně a buňky lze vysledovat od dárce k příjemci a naopak, požádají o akreditaci, jmenování, oprávnění nebo povolení coby dovážející tkáňové zařízení tak, že:
|
a) |
příslušnému orgánu či orgánům poskytnou požadované informace a dokumentaci stanovené v příloze I této směrnice; |
|
b) |
zpřístupní a, jsou-li o to požádána příslušným orgánem či orgány, poskytnou dokumentaci uvedenou v příloze III této směrnice. |
2. Členské státy nemusí uplatnit požadavky na dokumentaci stanovené v příloze I části F a v příloze III této směrnice na jednorázový dovoz definovaný v článku 2 této směrnice za podmínky, že mají zavedena vhodná vnitrostátní opatření, která uvedený dovoz regulují. Tato vnitrostátní opatření musí zajistit:
|
a) |
sledovatelnost od dárce k příjemci a naopak a |
|
b) |
že dovezené tkáně a buňky nejsou použity u nikoho jiného než u zamýšlených příjemců. |
Článek 6
Aktualizace údajů
1. Dovážející tkáňová zařízení požádají příslušný orgán nebo orgány o předchozí písemný souhlas, jestliže plánují jakékoli podstatné změny ve svých činnostech v oblasti dovozu, zejména jedná-li se o podstatné změny uvedené v čl. 3 odst. 3, a informují příslušný orgán nebo orgány o svém rozhodnutí zčásti nebo zcela ukončit své činnosti v oblasti dovozu.
2. Dovážející tkáňová zařízení neprodleně informují příslušný orgán či orgány o veškerých závažných nežádoucích účincích či reakcích nebo o jakémkoli podezření na takový účinek či reakci, které jim nahlásí dodavatelé ze třetích zemí a které mohou ovlivnit kvalitu a bezpečnost tkání a buněk, které dováží. V těchto oznámeních musí být uvedeny údaje stanovené v příloze III a IV směrnice 2006/86/ES.
3. Dovážející tkáňové zařízení neprodleně oznámí příslušnému orgánu či orgánům:
|
a) |
jakékoli částečné nebo úplné zrušení či pozastavení povolení dodavatele ze třetí země vyvážet tkáně a buňky a |
|
b) |
jakékoli jiné rozhodnutí přijaté příslušným orgánem nebo orgány země, v níž sídlí dodavatel ze třetí země, z důvodu nesplnění příslušných podmínek, které může mít význam s ohledem na kvalitu a bezpečnost dovážených tkání a buněk. |
Článek 7
Písemné dohody
1. Dovážející tkáňová zařízení musí mít s dodavateli ze třetích zemí uzavřeny písemné dohody, pokud kterákoli z činností darování, odběru, vyšetřování, zpracování, konzervace, skladování nebo vývozu do Unie tkání a buněk, jež mají být dovezeny do Unie, probíhá mimo Unii.
Členské státy nemusí tento požadavek uplatnit na jednorázový dovoz definovaný v článku 2 této směrnice za podmínky, že mají zavedena vhodná vnitrostátní opatření, která uvedený dovoz regulují. Tato vnitrostátní opatření musí zajistit:
|
a) |
sledovatelnost od dárce k příjemci a naopak a |
|
b) |
že dovezené tkáně a buňky nejsou použity u nikoho jiného než u zamýšlených příjemců. |
2. Písemná dohoda mezi dovážejícím tkáňovým zařízením a dodavatelem ze třetí země musí stanovit jakostní a bezpečnostní požadavky, které musí být splněny v zájmu zajištění rovnocennosti jakostních a bezpečnostních norem pro tkáně a buňky, které mají být dováženy, s normami stanovenými ve směrnici 2004/23/ES. Písemná dohoda musí konkrétně obsahovat alespoň položky uvedené v příloze IV této směrnice.
3. Písemná dohoda stanoví právo příslušného orgánu nebo orgánů provádět inspekci činností, včetně zařízení, veškerých dodavatelů ze třetích zemí během trvání písemné dohody a po dobu dvou let po jejím ukončení.
4. Dovážející tkáňová zařízení poskytnou kopie písemných dohod s dodavateli ze třetích zemí příslušnému orgánu či orgánům coby součást žádosti o akreditaci, jmenování, oprávnění či povolení.
Článek 8
Registr dovážejících tkáňových zařízení
1. Dovážející tkáňová zařízení vedou záznamy o svých činnostech, včetně druhů a množství dovážených tkání a buněk, jakož i jejich původu a určení. Tyto záznamy rovněž obsahují stejné informace o veškerých provedených jednorázových dovozech. Roční zpráva uvedená v čl. 10 odst. 1 směrnice 2004/23/ES musí obsahovat informace o těchto činnostech.
2. Příslušný orgán nebo orgány zahrnou dovážející tkáňová zařízení do veřejně přístupného registru tkáňových zařízení stanoveného v čl. 10 odst. 2 směrnice 2004/23/ES.
3. Informace o akreditacích, jmenováních, oprávněních nebo povoleních pro dovážející tkáňová zařízení musí být rovněž zpřístupněny prostřednictvím sítě registrů uvedené v čl. 10 odst. 3 směrnice 2004/23/ES.
KAPITOLA IV
ZÁVĚREČNÁ USTANOVENÍ
Článek 9
Provedení
1. Členské státy přijmou a zveřejní právní a správní předpisy nezbytné pro dosažení souladu s touto směrnicí do 29. října 2016. Neprodleně sdělí Komisi jejich znění.
Použijí tyto předpisy ode dne 29. dubna 2017.
Tyto předpisy přijaté členskými státy musí obsahovat odkaz na tuto směrnici nebo musí být takový odkaz učiněn při jejich úředním vyhlášení. Způsob odkazu si stanoví členské státy.
2. Členské státy sdělí Komisi znění hlavních ustanovení vnitrostátních právních předpisů, které přijmou v oblasti působnosti této směrnice.
Článek 10
Vstup v platnost
Tato směrnice vstupuje v platnost dvacátým dnem po vyhlášení v Úředním věstníku Evropské unie.
Článek 11
Určení
Tato směrnice je určena členským státům.
V Bruselu dne 8. dubna 2015.
Za Komisi
předseda
Jean-Claude JUNCKER
(1) Úř. věst. L 102, 7.4.2004, s. 48.
(2) Směrnice Komise 2006/17/ES ze dne 8. února 2006, kterou se provádí směrnice Evropského parlamentu a Rady 2004/23/ES, pokud jde o určité technické požadavky na darování, opatřování a vyšetřování lidských tkání a buněk (Úř. věst. L 38, 9.2.2006, s. 40).
(3) Směrnice Komise 2006/86/ES ze dne 24. října 2006, kterou se provádí směrnice Evropského parlamentu a Rady 2004/23/ES, pokud jde o požadavky na sledovatelnost, oznamování závažných nežádoucích reakcí a účinků a některé technické požadavky na kódování, zpracování, konzervaci, skladování a distribuci lidských tkání a buněk (Úř. věst. L 294, 25.10.2006, s. 32).
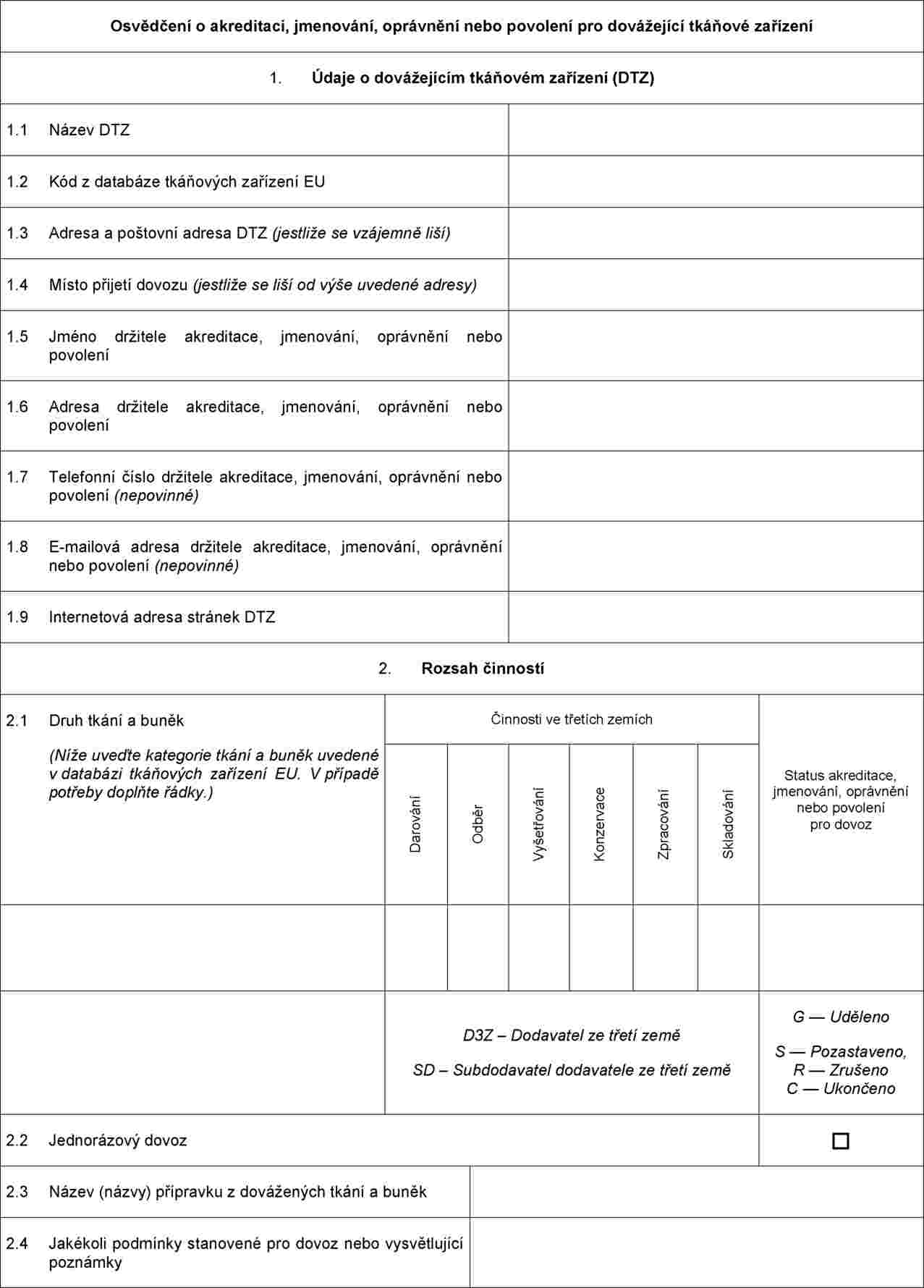
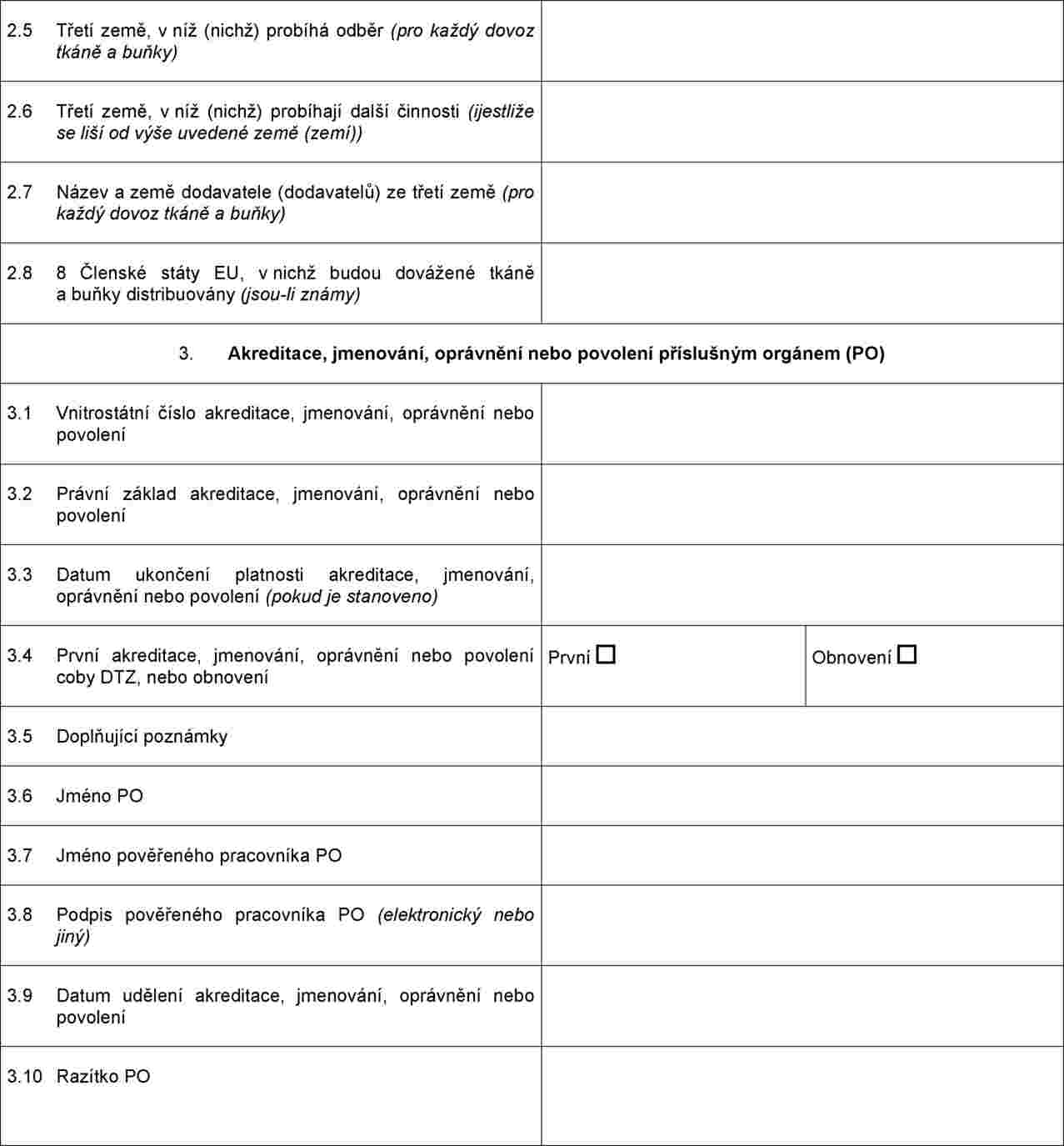
PŘÍLOHA I
Minimální požadavky týkající se informací a dokumentace, které musí spolu s žádostí o akreditaci, jmenování, oprávnění nebo povolení pro účely dovozu předložit dovážející tkáňová zařízení
Při žádosti o akreditaci, jmenování, oprávnění nebo povolení pro účely dovozu musí dovážející tkáňové zařízení předložit co nejaktuálnější informace a v případě části F dokumentaci k následujícím položkám (pokud již tyto informace a dokumentace nebyly předloženy v rámci dřívějších žádostí o akreditaci, jmenování, oprávnění nebo povolení coby tkáňové zařízení nebo dovážející tkáňové zařízení):
A. Obecné informace o dovážejícím tkáňovém zařízení (DTZ)
|
1. |
Název DTZ (jméno společnosti). |
|
2. |
Adresa pro návštěvy DTZ. |
|
3. |
Poštovní adresa DTZ (jestliže se liší od adresy pro návštěvy). |
|
4. |
Status DTZ předkládajícího žádost: Zde je třeba uvést, zda se jedná o první žádost o akreditaci, jmenování, oprávnění nebo povolení coby DTZ, nebo zda se případně jedná o žádost o obnovení. Jestliže žadateli již byla udělena akreditace, jmenování, oprávnění nebo povolení coby tkáňovému zařízení, je třeba uvést jeho databázový kód. |
|
5. |
Jméno oddělení předkládajícího žádost (jestliže se liší od jména společnosti). |
|
6. |
Adresa pro návštěvy oddělení předkládajícího žádost. |
|
7. |
Poštovní adresa oddělení předkládajícího žádost (jestliže se liší od adresy pro návštěvy). |
|
8. |
Jméno lokality pro příjem dovozu (jestliže se liší od jména společnosti a oddělení předkládajícího žádost). |
|
9. |
Adresa pro návštěvy lokality pro příjem dovozu. |
|
10. |
Poštovní adresa lokality pro příjem dovozu (jestliže se liší od adresy pro návštěvy). |
B. Kontaktní údaje, které musí být uvedeny v žádosti
|
1. |
Jméno kontaktní osoby pro žádost. |
|
2. |
Telefon. |
|
3. |
E-mailová adresa. |
|
4. |
Jméno odpovědné osoby (jestliže se liší od kontaktní osoby). |
|
5. |
Telefon. |
|
6. |
E-mailová adresa. |
|
7. |
Internetová adresa stránek DTZ (pokud existují). |
C. Podrobnosti o tkáních a buňkách, jež mají být dováženy
|
1. |
Seznam druhů tkání a buněk, jež mají být dováženy, včetně jednorázového dovozu specifických druhů tkání nebo buněk. |
|
2. |
Název přípravku (je-li to možné, podle obecného seznamu EU) všech druhů tkání a buněk, jež mají být dováženy. |
|
3. |
Obchodní název (jestliže se liší od názvu přípravku) všech druhů tkání a buněk, jež mají být dováženy. |
|
4. |
Pro každý druh tkáně a buňky, jež má být dovážen, jméno dodavatele ze třetí země. |
D. Místo, kde činnosti probíhají
|
1. |
Seznam uvádějící u každého druhu tkáně nebo buňky, které z činností darování, odběru, vyšetřování, zpracování, konzervace nebo skladování před dovozem provádí dodavatel ze třetí země. |
|
2. |
Seznam uvádějící u každého druhu tkáně nebo buňky, které z činností darování, odběru, vyšetřování, zpracování, konzervace nebo skladování před dovozem provádí subdodavatelé ze třetí země. |
|
3. |
Seznam všech činností, které DTZ po dovozu provádí u každého druhu tkáně nebo buňky. |
|
4. |
U každého druhu tkáně nebo buňky názvy třetích zemí, v nichž probíhají činnosti před dovozem. |
E. Podrobnosti o dodavatelích ze třetích zemí
|
1. |
Název dodavatele (dodavatelů) ze třetí země (jméno společnosti). |
|
2. |
Jméno kontaktní osoby. |
|
3. |
Adresa pro návštěvy. |
|
4. |
Poštovní adresa (jestliže se liší od adresy pro návštěvy). |
|
5. |
Telefonní číslo (včetně mezinárodního předčíslí). |
|
6. |
Telefonní číslo pro naléhavé situace (jestliže se liší od výše uvedeného tel. č.). |
|
7. |
E-mailová adresa. |
F. Dokumentace, která musí být přiložena k žádosti
|
1. |
Kopie písemné dohody s dodavatelem (dodavateli) ze třetí země. |
|
2. |
Podrobný popis pohybu dovezených tkání a buněk od jejich odběru až po přijetí v dovážejícím tkáňovém zařízení. |
|
3. |
Kopie osvědčení o povolení k vývozu dodavatele ze třetí země nebo, pokud se žádné specifické osvědčení o povolení k vývozu nevydává, osvědčení od příslušného orgánu nebo orgánů třetí země povolující činnosti dodavatele ze třetí země v odvětví tkání a buněk, včetně vývozu. Tato dokumentace musí rovněž obsahovat kontaktní údaje na příslušný orgán nebo orgány třetí země. V případě třetích zemí, kde tato dokumentace není k dispozici, je třeba poskytnout jiné dokumenty, například zprávy o auditu dodavatele ze třetí země. |
PŘÍLOHA II
Osvědčení o akreditaci, jmenování, oprávnění nebo povolení, které vydává příslušný orgán nebo orgány dovážejícím tkáňovým zařízením
PŘÍLOHA III
Minimální požadavky týkající se dokumentace, kterou musí tkáňová zařízení hodlající dovážet tkáně a buňky ze třetích zemí poskytnout příslušnému orgánu či orgánům
S výjimkou jednorázového dovozu definovaného v článku 2 této směrnice, na který se tyto požadavky na dokumentaci nevztahují, zpřístupní dovážející tkáňové zařízení předkládající žádost a, jestliže již tak neučinilo v rámci dřívějších žádostí o akreditaci, jmenování, oprávnění nebo povolení coby dovážející tkáňové zařízení nebo tkáňové zařízení, poskytne na žádost příslušného orgánu nebo orgánů nejaktuálnější verzi níže uvedených dokumentů týkajících se žadatele a jeho dodavatele (dodavatelů) ze třetí země.
A. Dokumentace týkající se dovážejícího tkáňového zařízení
|
1. |
Náplň práce odpovědné osoby a podrobnosti o její příslušné kvalifikaci a vzdělání, jak stanoví směrnice 2004/23/ES. |
|
2. |
Kopie původního štítku, štítku nového balení, vnějšího obalu a přepravní nádoby. |
|
3. |
Seznam aktuálních verzí standardních pracovních postupů týkajících se činností v oblasti dovozu příslušného zařízení včetně postupů pro uplatňování jednotného evropského kódu, přijímání a skladování dovážených tkání a buněk v dovážejícím tkáňovém zařízení, řízení nežádoucích účinků a reakcí, řízení stahování přípravků z distribuce a sledovatelnosti od dárce k příjemci. |
B. Dokumentace týkající se dodavatele či dodavatelů ze třetích zemí
|
1. |
Podrobný popis kritérií používaných pro identifikaci a hodnocení dárce, informace poskytované dárci nebo jeho rodině, způsob, jakým je získáván souhlas dárce či jeho rodiny, a zda bylo darování dobrovolné a neplacené, či nikoli. |
|
2. |
Podrobné informace ohledně vyšetřovacího střediska (středisek) využívaného dodavateli ze třetí země a testů, které uvedené středisko (střediska) provádí. |
|
3. |
Podrobné informace o metodách používaných během zpracovávání tkání a buněk, včetně podrobností ohledně validace kritické metody zpracování. |
|
4. |
U každé činnosti prováděné dodavatelem ze třetí země podrobný popis prostor, nejdůležitějšího vybavení, materiálů a kritérií používaných pro kontrolu kvality a kontrolu prostředí. |
|
5. |
Podrobné informace o podmínkách pro propuštění tkání a buněk dodavatelem nebo dodavateli ze třetí země. |
|
6. |
Podrobnosti o případných subdodavatelích využívaných dodavateli ze třetí země, včetně jména, místa a prováděné činnosti. |
|
7. |
Shrnutí poslední inspekce provedené u dodavatele ze třetí země příslušným orgánem nebo orgány třetí země, včetně data a typu inspekce, jakož i hlavních závěrů. |
|
8. |
Shrnutí posledního auditu provedeného u dodavatele ze třetí země dovážejícím tkáňovým zařízením nebo jeho jménem. |
|
9. |
Veškeré příslušné vnitrostátní nebo mezinárodní akreditace. |
PŘÍLOHA IV
Minimální požadavky týkající se obsahu písemných dohod mezi dovážejícími tkáňovými zařízeními a jejich dodavateli ze třetích zemí
S výjimkou jednorázového dovozu definovaného v článku 2 této směrnice, na který se tyto požadavky nevztahují, musí písemná dohoda mezi dovážejícím tkáňovým zařízením a dodavatelem ze třetí země obsahovat alespoň níže uvedená ustanovení.
|
1. |
Podrobné informace o specifikacích dovážejícího tkáňového zařízení s cílem zajistit, aby byly splněny jakostní a bezpečnostní normy stanovené ve směrnici 2004/23/ES a vzájemně odsouhlasené role a povinnosti obou stran při zajišťování rovnocennosti jakostních a bezpečnostních norem pro dovážené tkáně a buňky. |
|
2. |
Ujednání s cílem zajistit, aby dodavatel ze třetí země poskytl dovážejícímu tkáňovému zařízení informace stanovené v příloze III části B této směrnice. |
|
3. |
Ujednání s cílem zajistit, aby dodavatel ze třetí země informoval dovážející tkáňové zařízení o jakémkoli závažném nežádoucím účinku či reakci nebo podezření na ně, jež mohou ovlivnit kvalitu a bezpečnost tkání a buněk, které byly nebo mají být dovezeny dovážejícím tkáňovým zařízením. |
|
4. |
Ujednání s cílem zajistit, aby dodavatel ze třetí země informoval dovážející tkáňové zařízení o jakýchkoli podstatných změnách svých činností, včetně částečného nebo úplného zrušení nebo pozastavení povolení vyvážet tkáně a buňky nebo o jiných takových rozhodnutích příslušného orgánu nebo orgánů třetí země týkajících se nesplnění příslušných podmínek, jež mohou ovlivnit kvalitu a bezpečnost tkání a buněk, které byly nebo mají být dovezeny dovážejícím tkáňovým zařízením. |
|
5. |
Ujednání zaručující příslušnému orgánu či orgánům právo provést inspekci činností dodavatele ze třetí země, včetně inspekcí na místě, pokud by k ní uvedený orgán chtěl přistoupit v rámci inspekce dovážejícího tkáňového zařízení. Uvedené ujednání by rovněž mělo zaručit dovážejícímu tkáňovému zařízení právo provádět pravidelný audit svého dodavatele ze třetí země. |
|
6. |
Podmínky, na nichž se strany shodly a které musí být splněny při přepravě tkání a buněk mezi dodavatelem ze třetí země a dovážejícím tkáňovým zařízením. |
|
7. |
Ujednání s cílem zajistit, aby záznamy o dárci týkající se dovážených tkání a buněk byly uchovávány dodavatelem ze třetí země nebo jeho subdodavatelem v souladu s pravidly EU o ochraně údajů po dobu 30 let od odběru a aby bylo zajištěno jejich náležité uchování v případě, že by dodavatel ze třetí země ukončil svoji činnost. |
|
8. |
Ustanovení o pravidelném přezkumu a v nezbytných případech i revizi písemné dohody, včetně úprav odrážejících případné změny v požadavcích jakostních a bezpečnostních norem EU stanovených ve směrnici 2004/23/ES. |
|
9. |
Seznam veškerých standardních pracovních postupů dodavatele ze třetí země souvisejících s kvalitou a bezpečností dovážených tkání a buněk a závazek tyto postupy na požádání poskytnout. |