(ES) č. 2007/2006Nařízení Komise (ES) č. 2007/2006 ze dne 22. prosince 2006 o provádění nařízení Evropského parlamentu a Rady (ES) č. 1774/2002, pokud jde o dovoz a tranzit některých meziproduktů z materiálů kategorie 3 určených k technickému použití ve zdravotnických prostředcích, in vitro diagnostikách a laboratorních činidlech, a o změně uvedeného nařízení (Text s významem pro EHP)
| Publikováno: | Úř. věst. L 379, 28.12.2006, s. 98-104 | Druh předpisu: | Nařízení |
| Přijato: | 22. prosince 2006 | Autor předpisu: | Evropská komise |
| Platnost od: | 31. prosince 2006 | Nabývá účinnosti: | 1. ledna 2007 |
| Platnost předpisu: | Zrušen předpisem (EU) č. 142/2011 | Pozbývá platnosti: | 4. března 2011 |
Text předpisu s celou hlavičkou je dostupný pouze pro registrované uživatele.
NAŘÍZENÍ KOMISE (ES) č. 2007/2006
ze dne 22. prosince 2006
o provádění nařízení Evropského parlamentu a Rady (ES) č. 1774/2002, pokud jde o dovoz a tranzit některých meziproduktů z materiálů kategorie 3 určených k technickému použití ve zdravotnických prostředcích, in vitro diagnostikách a laboratorních činidlech, a o změně uvedeného nařízení
(Text s významem pro EHP)
KOMISE EVROPSKÝCH SPOLEČENSTVÍ,
s ohledem na Smlouvu o založení Evropského společenství,
s ohledem na nařízení Evropského parlamentu a Rady (ES) č. 1774/2002 ze dne 3. října 2002 o hygienických pravidlech pro vedlejší produkty živočišného původu, které nejsou určeny pro lidskou spotřebu (1), a zejména na čl. 32 odst. 1 a přílohu VIII kapitolu IV písm. A) bod 4 uvedeného nařízení,
vzhledem k těmto důvodům:
|
(1) |
Nařízení (ES) č. 1774/2002 stanoví, že některé vedlejší produkty živočišného původu mohou být dováženy do Společenství k výrobě technických výrobků, pokud jsou v souladu s uvedeným nařízením. |
|
(2) |
Příloha VIII nařízení (ES) č. 1774/2002 stanoví požadavky pro uvádění na trh některých technických výrobků, včetně výchozích materiálů používaných k výrobě nebo při výrobě technických výrobků, které mohou zahrnovat zdravotnické prostředky, in vitro diagnostiky a laboratorní činidla. |
|
(3) |
Některé členské státy, obchodní partneři a hospodářské subjekty však vyjádřili obavy týkající se dovozu některých produktů pocházejících z materiálů kategorie 3 určených k výrobě zdravotnických prostředků, in vitro diagnostik a laboratorních činidel (dále jen „meziprodukty“). Je proto nezbytné upřesnit dovozní požadavky a stanovit pro tyto meziprodukty zvláštní podmínky. |
|
(4) |
Ačkoli dotčené meziprodukty mohly podstoupit předběžnou úpravu, způsob jejich přepravy do Společenství neumožňuje odlišit je od jiných druhů vedlejších produktů živočišného původu určených k jiným technickým použitím; zohlednit lze pouze jejich zamýšlené místo určení a využití. Za předpokladu že se uplatňuje postup vhodný vzhledem k rizikům, zaznamenávání a kontrolní opatření, by monitorování jejich zamýšleného místa určení a použití podle jiných právních předpisů Společenství mělo dostatečně zajistit, že se v pozdější fázi nedostanou do potravního nebo krmivového řetězce. |
|
(5) |
Uvedení dotčených meziproduktů na trh by proto mělo postupovat v souladu se směrnicí Rady 97/78/ES ze dne 18. prosince 1997, kterou se stanoví základní pravidla pro veterinární kontroly produktů ze třetích zemí dovážených do Společenství (2), a mělo by podléhat zvláštním identifikačním a kontrolním opatřením, jimiž se omezí riziko zavlečení do potravního a krmivového řetězce a jiných neúmyslných použití. |
|
(6) |
Příloha VIII nařízení (ES) č. 1774/2002 stanoví požadavky na uvedení technických výrobků na trh. Jakmile skončí přechodný režim stanovený uvedeným nařízením, je třeba provést celkové přehodnocení a upřesnění této přílohy. Je proto vhodné do té doby stanovit ve zvláštním nařízení, které doplní pravidla již stanovená v uvedené příloze, pravidla dovozu meziproduktů určených k technickým použitím ve zdravotnických prostředcích, in vitro diagnostikách a laboratorních činidlech. |
|
(7) |
Než se provede celkové přehodnocení a upřesnění, je nezbytné upřesnit oblast působnosti kapitol IV a XI přílohy VIII nařízení (ES) č. 1774/2002 a zohlednit tak toto zvláštní nařízení, které se právě stanoví. Pravidla uvedená v kapitole IV by se měla týkat krve používané ke všem technickým účelům a krevních výrobků jiných než séra koňovitých používaného k technickým účelům jiným než ve zdravotnických prostředcích, in vitro diagnostikách nebo laboratorních činidlech. Pravidla uvedená v kapitole V by se měla nadále týkat séra koňovitých používaného k jakýmkoli technickým účelům, včetně použití ve zdravotnických prostředcích, in vitro diagnostikách nebo laboratorních činidlech, a tato pravidla proto není třeba měnit. Pravidla uvedená v kapitole XI by se měla týkat dovozu jiných nezpracovaných vedlejších produktů živočišného původu, na něž se toto nařízení nevztahuje, dovezených k jakýmkoli účelům, včetně použití ve zdravotnických prostředcích, in vitro diagnostikách nebo laboratorních činidlech. |
|
(8) |
V důsledku tohoto upřesnění je třeba provést změny některých vzorů veterinárních osvědčení uvedených v příloze X nařízení (ES) č. 1774/2002. |
|
(9) |
Opatření tohoto nařízení jsou v souladu se stanoviskem Stálého výboru pro potravinový řetězec a zdraví zvířat, |
PŘIJALA TOTO NAŘÍZENÍ:
Článek 1
Oblast působnosti
Toto nařízení se použije na dovoz a tranzit „meziproduktů“ definovaných v článku 2 tohoto nařízení přes Společenství.
Článek 2
Definice
„Meziproduktem“ se rozumí produkt z materiálu kategorie 3 určený k výrobě zdravotnických prostředků, in vitro diagnostik nebo laboratorních činidel, jehož fáze návrhu, zpracování a výroby byly řádně dokončeny a je tedy možné pokládat jej za zpracovaný produkt a přizpůsobit materiál tomuto účelu, aby byl s výjimkou některých dalších nezbytných úprav nebo úkonů, jako je míšení, potahování, montování, balení nebo označování, připraven k uvedení na trh nebo do provozu v souladu s právními předpisy Společenství použitelnými pro dotčené konečné produkty.
Článek 3
Dovoz
Členské státy povolí dovoz meziproduktů, které splňují tyto podmínky:
|
a) |
pocházejí ze třetí země uvedené na seznamu členů Světové organizace pro zdraví zvířat (OIE) v bulletinu OIE; |
|
b) |
pocházejí ze zařízení registrovaného nebo schváleného příslušným orgánem třetí země uvedené v písmenu a) tohoto článku v souladu s podmínkami stanovenými v příloze I tohoto nařízení; |
|
c) |
pocházejí výhradně z materiálů kategorie 3; |
|
d) |
každá zásilka musí být opatřena obchodním dokladem, v němž se uvádí:
Obchodní doklad musí být alespoň v jednom z úředních jazyků členského státu EU, v němž se provádí kontrola na stanovišti hraniční kontroly, a členského státu EU určení. Je-li to nezbytné, mohou členské státy povolit i jiné jazyky, k nimž bude připojen úřední překlad. |
|
e) |
je k nim připojeno prohlášení dovozce v souladu se vzorovým prohlášením uvedeným v příloze II tohoto nařízení. Prohlášení musí být alespoň v jednom z úředních jazyků členského státu EU, v němž se provádí kontrola na stanovišti hraniční kontroly, a členského státu EU určení. Je-li to nezbytné, mohou členské státy povolit i jiné jazyky, k nimž bude připojen úřední překlad. |
Článek 4
Kontroly, přeprava a označování
1. Meziprodukty dovezené do Společenství se kontrolují na stanovišti hraniční kontroly prvního vstupu v souladu s článkem 4 směrnice 97/78/ES a přepraví se ze stanoviště hraniční kontroly vstupu přímo do Společenství, a to buď:
|
a) |
do technického zařízení schváleného podle článku 18 nařízení (ES) č. 1774/2002, kde se meziprodukty před uvedením na trh nebo do provozu dále mísí, potahují, montují, balí nebo označují v souladu s právními předpisy Společenství použitelnými pro konečné produkty; nebo |
|
b) |
do zařízení pro přechodnou manipulaci kategorie 3 nebo zařízení k uskladnění, která jsou schválena v souladu s čl. 10 odst. 3 nebo článkem 11 nařízení (ES) č. 1774/2002. |
2. Meziprodukty, které přecházejí přes Společenství, se přepravují v souladu s článkem 11 směrnice 97/78/ES.
3. Úřední veterinární lékař na dotčeném stanovišti hraniční kontroly uvědomí prostřednictvím systému TRACES orgán, který je odpovědný za zařízení v místě určení zásilky.
4. Na vnějším obalu meziproduktů je uvedeno označení: „POUZE PRO POUŽITÍ VE ZDRAVOTNICKÝCH PROSTŘEDCÍCH/IN VITRO DIAGNOSTIKÁCH/LABORATORNÍCH ČINIDLECH“.
Článek 5
Použití a odeslání
Provozovatel nebo vlastník zařízení v místě určení nebo jeho zástupce použije a/nebo odešle meziprodukty výhradně k technickým účelům upřesněným ve schválení zařízení, jak je uvedeno v čl. 4 odst. 1 písm. a).
Článek 6
Záznamy o použití a odeslání
Provozovatel nebo vlastník zařízení v místě určení nebo jeho zástupce vede záznamy v souladu čl. 9 odst. 1 nařízení (ES) č. 1774/2002 a za účelem ověření souladu s tímto nařízením poskytne příslušnému orgánu na jeho žádost nezbytné údaje o nákupu, prodeji, použití, skladování a zneškodnění přebytečných meziproduktů.
Článek 7
Kontrola
1. Příslušný orgán v souladu se směrnicí 97/78/ES zajistí, aby zásilky meziproduktů byly odesílány z členských států EU, v nichž se provádí kontrola na stanovišti hraniční kontroly, do zařízení v místě určení, jak uvádí čl. 4 odst. 1 tohoto nařízení, nebo v případě tranzitu do místa výstupu.
2. Příslušný orgán provádí v pravidelných intervalech kontrolu dokumentů za účelem odsouhlasení souladu množství meziproduktů, které jsou dováženy, a meziproduktů, které jsou skladovány, používány, odeslány nebo zneškodněny, aby ověřil soulad s tímto nařízením.
3. V případě zásilek meziproduktů v režimu tranzitu příslušné orgány odpovědné za stanoviště hraničních kontrol vstupu a místa výstupu co nejlépe spolupracují, aby zajistily provádění účinných kontrol a zpětnou vysledovatelnost takových zásilek.
Článek 8
Změna příloh VIII a X nařízení (ES) č. 1774/2002
Přílohy VIII a X nařízení (ES) č. 1774/2002 se mění v souladu s přílohou III tohoto nařízení.
Článek 9
Vstup v platnost
Toto nařízení vstupuje v platnost třetím dnem po vyhlášení v Úředním věstníku Evropské unie.
Použije se ode dne 1. ledna 2007.
Toto nařízení je závazné v celém rozsahu a přímo použitelné ve všech členských státech.
V Bruselu dne 22. prosince 2006.
Za Komisi
Markos KYPRIANOU
člen Komise
(1) Úř. věst. L 273, 10.10.2002, s. 1. Nařízení naposledy pozměněné nařízením Komise (ES) č. 208/2006 (Úř. věst. L 36, 8.2.2006, s. 25–31).
(2) Úř. věst. L 24, 30.1.1998, s. 9. Směrnice naposledy pozměněná nařízením Evropského parlamentu a Rady (ES) č. 882/2004 (Úř. věst. č. L 165, 30.4.2004, s. 1).
PŘÍLOHA I
Podmínky registrace nebo schválení zařízení původu podle čl. 3 písm. b)
|
1. |
Provozovatel nebo vlastník zařízení nebo jeho zástupce:
|
|
2. |
Příslušný orgán třetí země provádí v pravidelných intervalech kontroly a dohlíží nad registrovaným nebo schváleným zařízením v souladu s tímto nařízením.
|
PŘÍLOHA II
Vzor prohlášení k dovozu meziproduktů, které jsou určeny k použití ve zdravotnických prostředcích, in vitro diagnostikách a laboratorních činidlech, ze třetích zemí a k tranzitu přes Evropské společenství
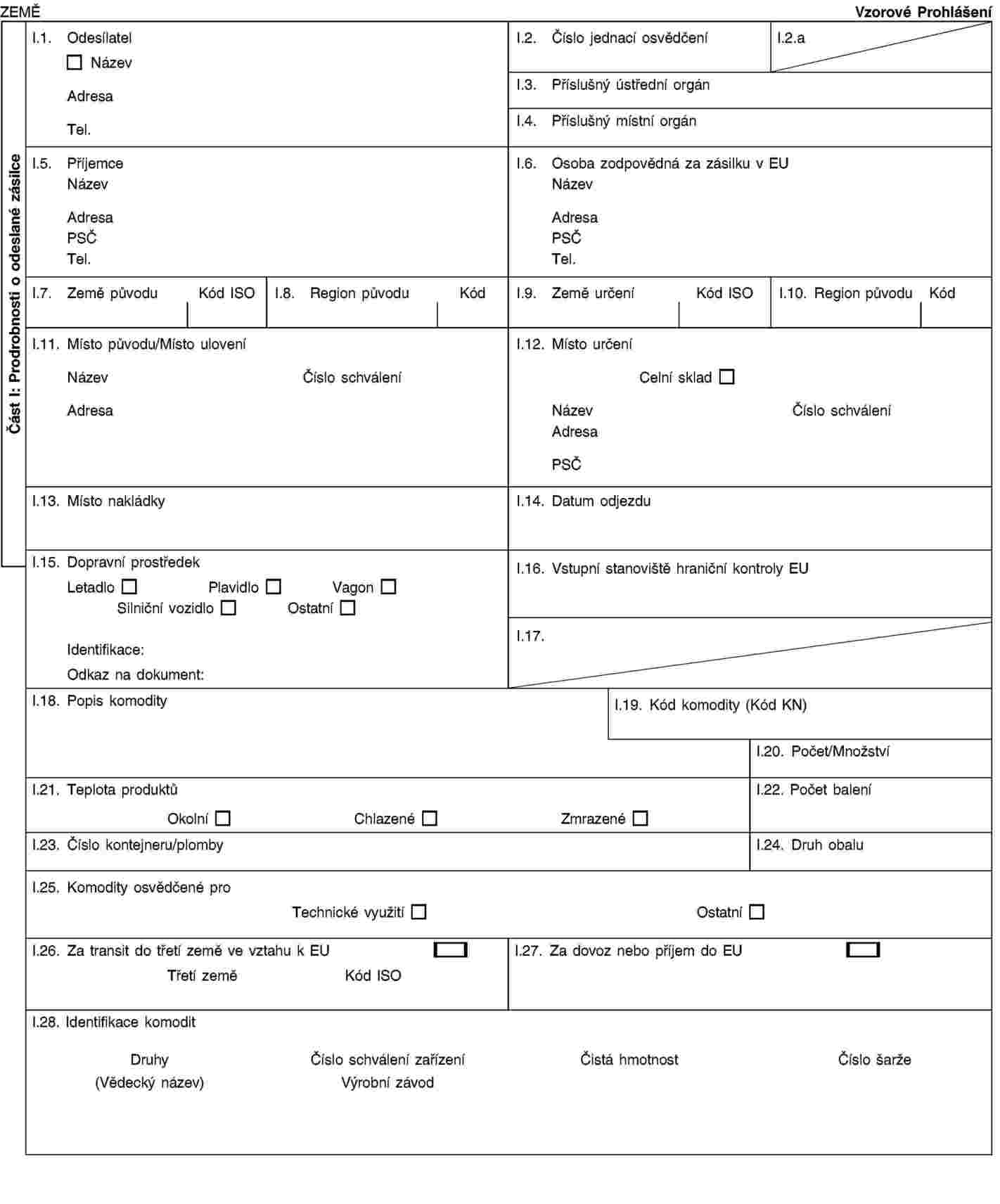
VZOR PROHLÁŠENÍ K ODESLÁNÍ NEBO K TRANZITU MEZIPRODUKTŮ, KTERÉ JSOU URČENY K POUŽITÍ VE ZDRAVOTNICKÝCH PROSTŘEDCÍCH, IN VITRO DIAGNOSTIKÁCH A LABORATORNÍCH ČINIDLECH, PŘES EVROPSKÉ SPOLEČENSTVÍ
Já, níže podepsaný, prohlašuji, že výše uvedené meziprodukty jsou určeny k dovozu mou osobou do Společenství a že:
|
1. |
jsou vyrobeny z materiálu kategorie 3 uvedené v článku 6 nařízení (ES) č. 1774/2002 (1) a jsou určeny k výrobě zdravotnických prostředků, in vitro diagnostik a laboratorních činidel; |
|
2. |
jejich fáze návrhu, zpracování a výroby byly řádně dokončeny a je tedy možné pokládat je za zpracované produkty a přizpůsobit je tomuto účelu, aby byly s výjimkou některých dalších nezbytných úprav nebo úkonů, jako je míšení, potahování, montování, balení nebo označování, připraveny k uvedení na trh nebo do provozu v souladu s právními předpisy Společenství použitelnými pro dotčené konečné produkty; |
|
3. |
na jejich vnějším obalu je uvedeno označení: „POUZE PRO POUŽITÍ VE ZDRAVOTNICKÝCH PROSTŘEDCÍCH/IN VITRO DIAGNOSTIKÁCH/LABORATORNÍCH ČINIDLECH“; a |
|
4. |
v žádné fázi nebudou ve Společenství použity v potravinách, krmných surovinách, organických hnojivech nebo půdních přídavcích a budou přepraveny přímo do tohoto zařízení.
Dovozce
V … dne …
Podpis … |
(1) Seznam materiálů kategorie 3 (uvedených v nařízení (ES) č. 1774/2002 – Úř. věst. L 273, 10.10.2002, s. 1):
|
a) |
části poražených zvířat, které jsou poživatelné v souladu s právními předpisy Společenství, ale které nejsou určené pro lidskou spotřebu z obchodních důvodů, |
|
b) |
části poražených zvířat, které byly prohlášeny za nepoživatelné, ale které nenesou žádné známky chorob přenosných na člověka nebo zvířata a které pochází z těl zvířat, která jsou poživatelná v souladu s právními předpisy Společenství, |
|
c) |
kůže, kopyta, paznehty a rohy, prasečí štětiny a peří pocházející ze zvířat poražených na jatkách, která prošla veterinární prohlídkou před porážkou a která byla v důsledku této prohlídky shledána vhodnými pro účely porážky pro lidskou spotřebu v souladu s právními předpisy Společenství, |
|
d) |
krev získaná ze zvířat jiných než přežvýkavců pocházející ze zvířat poražených na jatkách, která prošla veterinární prohlídkou před porážkou a která byla v důsledku této prohlídky shledána vhodnými pro účely porážky pro lidskou spotřebu v souladu s právními předpisy Společenství, |
|
e) |
vedlejší produkty živočišného původu pocházející z výroby produktů určených pro lidskou spotřebu včetně odtučněných kostí a škvarků, |
|
f) |
zmetkové potraviny živočišného původu, nebo zmetkové potraviny obsahující produkty živočišného původu, jiné než kuchyňský odpad, které nejsou již dále určeny pro lidskou spotřebu z komerčních důvodů nebo vzhledem k produkčním problémům či závadnému balení, které však nepředstavují žádné riziko pro zdraví lidi ani zvířat, |
|
g) |
syrové mléko pocházející ze zvířat, která nevykazují žádné klinické příznaky choroby přenosné tímto produktem na lidi nebo zvířata, |
|
h) |
ryby nebo ostatní mořští živočichové s výjimkou mořských savců, které byly uloveny na otevřeném moři za účelem výroby rybí moučky, |
|
i) |
vedlejší produkty z ryb pocházející ze zařízení na výrobu rybích výrobků pro lidskou spotřebu, |
|
j) |
skořápky, vedlejší produkty z umělých líhní, vedlejší produkty z porušených vajec, které pocházejí ze zvířat, která nevykazují žádné klinické příznaky choroby přenosné tímto produktem na lidi nebo zvířata. |
PŘÍLOHA III
Přílohy VIII a X nařízení (ES) č. 1774/2002 se mění takto:
|
(1) |
Příloha VIII se mění takto:
|
|
(2) |
Příloha X se mění takto:
|
(1) S výjimkou surové krve, syrového mléka, kůží kopytníků a prasečích štětin (viz příslušná konkrétní osvědčení pro dovoz těchto produktů), jakož i vlny, chlupů, peří nebo jeho částí. Toto osvědčení není určeno pro meziprodukty podle nařízení (ES) č. 2007/2006 (viz příslušné podmínky a vzory prohlášení pro dovoz těchto produktů).