2011/884/EU2011/884/EU: Prováděcí rozhodnutí Komise ze dne 22. prosince 2011 o mimořádných opatřeních týkajících se nepovolené geneticky modifikované rýže v produktech z rýže pocházejících z Číny a o zrušení rozhodnutí 2008/289/ES Text s významem pro EHP
| Publikováno: | Úř. věst. L 343, 23.12.2011, s. 140-148 | Druh předpisu: | Prováděcí rozhodnutí |
| Přijato: | 22. prosince 2011 | Autor předpisu: | Evropská komise |
| Platnost od: | 12. ledna 2012 | Nabývá účinnosti: | 12. ledna 2012 |
| Platnost předpisu: | Ano | Pozbývá platnosti: | |
Text aktualizovaného znění s celou hlavičkou je dostupný pouze pro registrované uživatele.
Tento dokument je třeba brát jako dokumentační nástroj a instituce nenesou jakoukoli odpovědnost za jeho obsah
|
PROVÁDĚCÍ ROZHODNUTÍ KOMISE ze dne 22. prosince 2011 o mimořádných opatřeních týkajících se nepovolené geneticky modifikované rýže v produktech z rýže pocházejících z Číny a o zrušení rozhodnutí 2008/289/ES (Text s významem pro EHP) (Úř. věst. L 343, 23.12.2011, p.140) |
Ve znění:
|
|
|
Úřední věstník |
||
|
No |
page |
date |
||
|
L 162 |
10 |
14.6.2013 |
||
PROVÁDĚCÍ ROZHODNUTÍ KOMISE
ze dne 22. prosince 2011
o mimořádných opatřeních týkajících se nepovolené geneticky modifikované rýže v produktech z rýže pocházejících z Číny a o zrušení rozhodnutí 2008/289/ES
(Text s významem pro EHP)
(2011/884/EU)
EVROPSKÁ KOMISE,
s ohledem na Smlouvu o fungování Evropské unie,
s ohledem na nařízení Evropského parlamentu a Rady (ES) č. 178/2002 ze dne 28. ledna 2002, kterým se stanoví obecné zásady a požadavky potravinového práva, zřizuje se Evropský úřad pro bezpečnost potravin a stanoví postupy týkající se bezpečnosti potravin ( 1 ), a zejména na čl. 53 odst. 1 uvedeného nařízení,
vzhledem k těmto důvodům:|
(1) |
Podle ustanovení čl. 4 odst. 2 a čl. 16 odst. 2 nařízení Evropského parlamentu a Rady (ES) č. 1829/2003 ze dne 22. září 2003 o geneticky modifikovaných potravinách a krmivech ( 2 ) nesmí být žádné geneticky modifikované potraviny nebo krmiva uváděny na trh Unie, pokud se na ně nevztahuje povolení udělené v souladu s uvedeným nařízením. Podle čl. 4 odst. 3 a čl. 16 odst. 3 téhož nařízení nesmí být povoleny žádné geneticky modifikované potraviny a krmiva, pokud nebylo řádně a dostatečně prokázáno, že nemají nepříznivé účinky na lidské zdraví, na zdraví zvířat nebo na životní prostředí, že neuvádějí spotřebitele nebo uživatele v omyl a že se neliší od potravin nebo krmiv, které mají nahradit, do té míry, že by jejich běžná spotřeba byla z hlediska výživové hodnoty pro člověka nebo zvířata nevýhodná. |
|
(2) |
V září 2006 byly ve Spojeném království, Francii a Německu objeveny a prostřednictvím systému včasné výměny informací pro potraviny a krmiva (RASFF) oznámeny produkty z rýže pocházející nebo zasílané z Číny, které byly kontaminovány nepovolenou geneticky modifikovanou rýží Bt 63. Navzdory opatřením ke kontrole přítomnosti uvedeného nepovoleného geneticky modifikovaného organismu (GMO), které oznámily čínské orgány, bylo následně hlášeno několik dalších varování týkajících se přítomnosti nepovolené geneticky modifikované rýže Bt 63. |
|
(3) |
Vzhledem k pokračujícím varováním a k tomu, že příslušné čínské orgány neposkytly dostatečné záruky toho, že produkty pocházející nebo zasílané z Číny již nebudou obsahovat nepovolenou geneticky modifikovanou rýži Bt 63, bylo přijato rozhodnutí Komise 2008/289/ES ( 3 ), kterým byla zavedena mimořádná opatření týkající se nepovoleného geneticky modifikovaného organismu Bt 63 v produktech z rýže. Podle uvedeného rozhodnutí bylo vyžadováno, aby provozovatelé před uvedením na trh předložili příslušným orgánům dotčeného členského státu analytickou zprávu, která dokazuje, že zásilka produktů z rýže není kontaminována geneticky modifikovanou rýží Bt 63. Uvedené rozhodnutí dále stanovilo, že členské státy přijmou vhodná opatření s ohledem na produkty předané k dovozu nebo již uvedené na trh, včetně namátkového odběru vzorků a analýzy prováděných metodou uvedenou v rozhodnutí. |
|
(4) |
Německo v březnu roku 2010 oznámilo RASFF výskyt nových odrůd rýže obsahujících nepovolené genetické prvky týkající se odolnosti proti hmyzu, které měly podobné vlastnosti jako GMO Kefeng 6. Následně bylo oznámeno několik podobných varování, které kromě Kefeng 6 ještě zahrnovaly přítomnost další linie rýže odolné proti hmyzu, která obsahovala genetické prvky podobající se GMO Kemingdao 1 (KMD1). Kefeng 6 a KMD1 nejsou v Unii ani v Číně povoleny. |
|
(5) |
Příslušné čínské orgány byly vyrozuměny o veškerých oznámeních RASFF a Komise kromě toho v červnu 2010 a v únoru 2011 písemně požádala příslušné orgány, aby přijaly opatření k řešení narůstajícího počtu varování. |
|
(6) |
Potravinový a veterinární úřad provedl v Číně v říjnu 2008 inspekci, aby posoudil provedení rozhodnutí 2008/289/ES, přičemž v březnu 2011 následovala další inspekce. V závěrech inspekce z roku 2008 a v prvotním zjištění inspekce z roku 2011 bylo uvedeno, že panují nejasnosti, pokud jde o rozsah, druh a množství geneticky modifikovaných odrůd rýže, které mohly kontaminovat produkty z rýže pocházející nebo zasílané z Číny, a v důsledku toho bylo zjištěno vysoké riziko, že do těchto produktů z rýže budou zavlékány další nepovolené geneticky modifikované organismy. |
|
(7) |
Vzhledem ke zjištěním inspekcí Potravinového a veterinárního úřadu z let 2008 a 2011 a četným oznámením RASFF, které se týkají případů souvisejících s nepovolenou geneticky modifikovanou rýží, by měla být opatření stanovená v rozhodnutí 2008/289/ES příslušným způsobem rozšířena tak, aby zabránila jakémukoli uvedení kontaminovaného produktu na trh Unie. Vzhledem k tomu je nutné nahradit rozhodnutí 2008/289/ES prostřednictvím tohoto rozhodnutí. |
|
(8) |
S přihlédnutím ke skutečnosti, že v Unii nejsou povoleny žádné geneticky modifikované produkty z rýže, je vhodné rozšířit opatření stanovená rozhodnutím 2008/289/ES, která se vztahují pouze na geneticky modifikovanou rýži Bt 63, tak aby byly zahrnuty veškeré geneticky modifikované organismy zjištěné v produktech z rýže pocházejících nebo zasílaných z Číny. Povinnost předložit analytickou zprávu o odběru vzorků a analýze, která prokazuje, že se nejedná o případy geneticky modifikované rýže, stanovená v rozhodnutí 2008/289/ES, by měla být zachována. Je však vhodné posílit kontroly členských států zvýšením četnosti odběru vzorků a analýz, přičemž by měla být stanovena úroveň na 100 % všech zásilek produktů z rýže pocházejících z Číny a zavedena povinnost pro provozovatele potravinářských a krmivářských podniků předem oznamovat předpokládané datum, čas a místo fyzického doručení zásilky. |
|
(9) |
Pro získání reprezentativních a srovnatelných výsledků hrají zásadní úlohu metody odběru vzorků; proto je vhodné stanovit společný protokol pro odběr vzorků a analýzu pro účely kontroly nepřítomnosti geneticky modifikované rýže v dovozu pocházejícím z Číny. Zásady pro postupy spolehlivého odběru vzorků jsou pro hromadné zemědělské produkty stanoveny v doporučení Komise 2004/787/ES ze dne 4. října 2004 o technických pokynech pro odběr vzorků a detekci geneticky modifikovaných organismů a materiálu vyrobeného z geneticky modifikovaných organismů nebo produktů s jejich obsahem podle nařízení (ES) č. 1830/2003 ( 4 ) a pro balené potraviny v CEN/TS 15568 nebo obdobné normě. Pokud jde o krmiva, použijí se zásady stanovené v nařízení Komise (ES) č. 152/2009 ze dne 27. ledna 2009, kterým se stanoví metody odběru vzorků a laboratorního zkoušení pro úřední kontrolu krmiv ( 5 ). |
|
(10) |
Vzhledem ke značnému počtu možných případů geneticky modifikované rýže a chybějícím validovaným metodám detekce a kontrolním vzorkům odpovídající kvality a kvantity a v zájmu usnadnění kontrol je vhodné nahradit metodu pro odběr vzorků a analýzu stanovenou v rozhodnutí 2008/289/ES analytickými screeningovými metodami stanovenými v příloze II. |
|
(11) |
Nové navrhované screeningové metody analýzy by měly být založeny na doporučení 2004/787/ES. V tomto doporučení se zejména zohledňuje skutečnost, že stávající metody, které jsou k dispozici, jsou kvalitativní a měly by řešit detekci nepovolených geneticky modifikovaných organismů, pro které není žádný toleranční práh pro odběr vzorků a analýzu. |
|
(12) |
Evropská referenční laboratoř pro geneticky modifikované potraviny a krmiva (EU-RLGMFF) v rámci Společného výzkumného střediska (JRC) ověřila a potvrdila vhodnost navržených screeningových metod pro detekci geneticky modifikované rýže. |
|
(13) |
Pro účely činností týkajících se odběru vzorků a detekce, které jsou vyžadovány k tomu, aby se zabránilo uvedení produktů obsahujících nepovolené případy rýže na trh, je nezbytné, aby jak provozovatelé tak i úřední útvary postupovali podle metod odběru vzorků a analýzy stanovených v příloze II. Zejména je nutné, aby byly zohledněny pokyny Evropské referenční laboratoře pro geneticky modifikované potraviny a krmiva pro použití těchto metod. |
|
(14) |
Produkty z rýže, které jsou uvedeny v příloze I, pocházející nebo zasílané z Číny, by měly být propuštěny do volného oběhu pouze tehdy, jsou-li provázeny analytickou zprávou a osvědčením o zdravotní nezávadnosti, které vydal Úřad Čínské lidové republiky pro vstupní a výstupní inspekci a karanténu (Entry Exit Inspection and Quarantine Bureau – AQSIQ) v souladu se vzory stanovenými v příloze III a IV tohoto rozhodnutí. |
|
(15) |
Aby bylo k dispozici průběžné hodnocení kontrolních opatření, je vhodné stanovit pro členské státy povinnost podávat Komisi pravidelné zprávy o úředních kontrolách zásilek produktů z rýže pocházejících nebo zasílaných z Číny. |
|
(16) |
Opatření stanovená v tomto rozhodnutí by měla být přiměřená a neměla by omezovat obchod více, než je nutné, a měla by se proto vztahovat pouze na produkty pocházející nebo zasílané z Číny, u nichž existuje pravděpodobnost, že jsou kontaminovány nepovolenými případy geneticky modifikované rýže. Vzhledem ke škále produktů, které by mohly být kontaminovány takovými nepovolenými případy geneticky modifikované rýže, se zdá být vhodné zaměřit se na veškeré potravinové a krmivářské produkty, v nichž je rýže uvedena jako jejich složka. Některé z produktů však rýži obsahovat, sestávat z ní nebo z ní být vyrobeny mohou nebo nemusí. Proto se zdá být vhodné umožnit provozovatelům, aby v případě, že daný produkt rýži neobsahuje, nesestává z ní nebo není z rýže vyroben, vydali jednoduché prohlášení, a nemuseli tak provádět analýzu a předkládat osvědčení. |
|
(17) |
Situace ohledně možné kontaminace produktů z rýže nepovolenými geneticky modifikovanými liniemi rýže by měla být do šesti měsíců přezkoumána s cílem posoudit, zda jsou opatření stanovená tímto rozhodnutím stále nezbytná. |
|
(18) |
Opatření stanovená tímto rozhodnutím jsou v souladu se stanoviskem Stálého výboru pro potravinový řetězec a zdraví zvířat, |
PŘIJALA TOTO ROZHODNUTÍ:
Článek 1
Oblast působnosti
1. Rozhodnutí se vztahuje na produkty uvedené v příloze I, které pocházejí nebo jsou zasílány z Číny.
2. Ve snaze zajistit soulad s čl. 4 odst. 3 a čl. 16 odst. 3 nařízení (ES) č. 1829/2003 mohou členské státy provádět namátkové fyzické kontroly podle přílohy II tohoto rozhodnutí i u jiných potravin a krmiv, než které jsou uvedeny v odstavci 1, které pocházejí nebo jsou zasílány z Číny, avšak které obsahují rýži, sestávají z ní nebo jsou z ní vyrobeny.
3. Toto rozhodnutí se nepoužije v případě zásilek potravin a krmiv uvedených v odstavci 1, které jsou určeny pro soukromé osoby pouze pro osobní spotřebu a použití. V případě pochybností nese důkazní břemeno příjemce zásilky.
Článek 2
Definice
1. Pro účely tohoto rozhodnutí se použijí definice stanovené v článcích 2 a 3 nařízení (ES) č. 178/2002, v článku 2 nařízení Evropského parlamentu a Rady (ES) č. 882/2004 ze dne 29. dubna 2004 o úředních kontrolách za účelem ověření dodržování právních předpisů týkajících se krmiv a potravin a pravidel o zdraví zvířat a dobrých životních podmínkách zvířat ( 6 ) a v čl. 3 písm. b) a c) nařízení Komise (ES) č. 669/2009 ( 7 ) týkajícího se zesílených úředních kontrol dovozu některých krmiv a potravin jiného než živočišného původu.
2. Použijí se rovněž tyto definice:
|
a) |
Partie : konkrétní a specifické množství materiálu. |
|
b) |
Dílčí vzorek : stejné malé množství produktu odebrané z každého místa odběru vzorků v partii zahrnující celou hloubku partie (statický vzorek), nebo odebrané z proudu produktu v průběhu daného časového intervalu (odběr vzorků tekoucích produktů). |
|
c) |
Hromadný vzorek : množství produktu získané kombinováním a mícháním dílčích vzorků odebraných z určité partie. |
|
d) |
Laboratorní vzorek : množství produktu odebrané z hromadného vzorku a určené k laboratorním inspekcím a testům. |
|
e) |
Analytický vzorek : homogenizovaný laboratorní vzorek sestávající buď z celého laboratorního vzorku, nebo jeho reprezentativní části. |
Článek 3
Oznamování zásilek předem
1. Provozovatelé krmivářských a potravinářských podniků nebo jejich zástupci odpovídajícím způsobem předem oznámí předpokládané datum a čas fyzického příchodu zásilky a druh zásilky příslušným orgánům na stanovišti hraniční kontroly nebo případně na určeném místě vstupu. Provozovatelé rovněž uvedou, zda je produkt určen jako potravina nebo krmivo.
2. Za tímto účelem vyplní příslušné části společného vstupního dokladu, který je uveden v příloze II nařízení (ES) č. 669/2009, nebo společného veterinárního vstupního dokladu podle článku 2 nařízení Komise (ES) č. 136/2004 ( 8 ) a zašlou tento doklad příslušnému orgánu na stanovišti hraniční kontroly nebo případně na určeném místě vstupu, a to nejméně jeden pracovní den před fyzickým příchodem zásilky.
3. Odstavce 1 a 2 se nepoužijí v případě produktů uvedených v příloze I, které neobsahují rýži, nesestávají z ní nebo z ní nejsou vyrobeny.
Článek 4
Podmínky dovozu
1. Každá zásilka produktů uvedených v článku 1 musí být provázena analytickou zprávou pro každou partii a osvědčením o zdravotní nezávadnosti v souladu se vzory stanovenými v přílohách III a IV, které je vyplněno, podepsáno a ověřeno oprávněným zástupcem „Úřadu Čínské lidové republiky pro vstupní a výstupní inspekci a karanténu“ (Entry Exit Inspection and Quarantine Bureau – AQSIQ). Analytická zpráva a osvědčení o zdravotní nezávadnosti musí být vystaveny v úředním jazyce členského státu dovozu, nebo v jiném jazyce, jejž se příslušné orgány uvedeného členského státu rozhodly akceptovat.
2. Pokud produkt uvedený v příloze I neobsahuje rýži, nesestává z ní nebo není z rýže vyroben, lze analytickou zprávu a osvědčení o zdravotní nezávadnosti nahradit prohlášením provozovatele odpovědného za zásilku s uvedením, že daná potravina nebo krmivo neobsahuje rýži, nesestává z ní nebo z ní není vyrobena(o). Toto prohlášení musí být vystaveno v úředním jazyce členského státu dovozu, nebo v jiném jazyce, jejž se příslušné orgány uvedeného členského státu rozhodly akceptovat.
3. Odběr vzorků a analýza pro účely analytických zpráv uvedených v odstavci 1 se provádí v souladu s přílohou II.
4. Každá zásilka se označí kódem, který se uvádí na osvědčení o zdravotní nezávadnosti. Každý pytel nebo jiný druh obalu v zásilce musí být takovým kódem označen.
Článek 5
Úřední kontroly
1. U každé zásilky produktů uvedených v článku 1 se provede kontrola dokladů, jejímž cílem je zajistit soulad s podmínkami dovozu stanovenými v článku 4.
2. Pokud není zásilka produktů neuvedených v čl. 4 odst. 2 provázena osvědčením o zdravotní nezávadnosti a analytickou zprávou stanovenou v článku 4, zásilka se odešle zpět do země původu nebo se zlikviduje.
3. Pokud je zásilka provázena osvědčením o zdravotní nezávadnosti a analytickou zprávou stanovenou v článku 4, příslušný orgán odebere vzorek za účelem provedení analýzy podle přílohy II na přítomnost nepovolených geneticky modifikovaných organismů, přičemž četnost je 100 %. Pokud se zásilka skládá z několika partií, provede se odběr vzorků a analýza u každé z nich.
4. Příslušný orgán může povolit další přepravu zásilky před tím, než jsou k dispozici výsledky fyzických kontrol. V takovém případě zůstane zásilka pod stálým dohledem příslušných orgánů, dokud nejsou k dispozici výsledky fyzických kontrol.
5. Po dokončení kontrol stanovených v odstavcích 1 a 4 příslušný orgán:
a) vyplní příslušnou část v části II společného vstupního dokladu nebo případně společného veterinárního vstupního dokladu a odpovědný úředník příslušného orgánu originál uvedeného dokladu orazítkuje a podepíše.
Společný vstupní doklad nebo případně společný vstupní veterinární doklad lze dokončit pouze, je-li k dispozici výsledek analýzy uvedené v odstavci 3;
b) podepsaný a razítkem opatřený společný vstupní doklad nebo případně společný vstupní veterinární doklad okopíruje a tuto kopii uschová.
Originál společného vstupního dokladu nebo případně společného vstupního veterinárního dokladu doprovází zásilku při její další přepravě, dokud se zásilka nedostane na na místo určení uvedené ve společném vstupním dokladu nebo společném vstupním veterinárním dokladu.
6. Propuštění zásilek do volného oběhu se povolí pouze tehdy, má-li se po odběru vzorků a analýzách provedených v souladu s přílohou II za to, že veškeré partie uvedené zásilky jsou v souladu s právem Unie. Tento požadavek se vztahuje též na zásilky kontrolované v souladu s čl. 1 odst. 2.
Článek 6
Podávání zpráv Komisi
1. Členské státy připraví každé tři měsíce zprávu o všech výsledcích všech analytických zkoušek, které byly provedeny za poslední tři měsíce a které se týkají zásilek produktů uvedených v článku 1.
Uvedené zprávy předloží Komisi v průběhu měsíce, který následuje po každém čtvrtletí: v dubnu, červenci, říjnu a lednu.
2. Tato zpráva obsahuje tyto informace:
a) počet zásilek, u kterých byl proveden odběr vzorků pro analýzu;
b) výsledky kontrol stanovených v článku 5;
c) počet zásilek, které byly odmítnuty, protože chybělo osvědčení o zdravotní nezávadnosti nebo analytická zpráva.
Článek 7
Rozdělení zásilky
Zásilky nelze rozdělovat, dokud příslušné orgány nedokončily všechny úřední kontroly.
V případě následného rozdělení po úřední kontrole musí být každá část rozdělené zásilky provázena ověřenou kopií osvědčení o zdravotní nezávadnosti a analytické zprávy.
Článek 8
Náklady
Veškeré náklady vyplývající z úředních kontrol, včetně odběru vzorků, analýzy, skladování a jakýchkoli opatření přijatých v návaznosti na nedodržení předpisů, nese provozovatel potravinářského či krmivářského podniku.
Článek 9
Přechodná ustanovení
Členské státy povolí dovoz zásilek produktů uvedených v čl. odst. 1, s výjimkou produktů uvedených v příloze I odpovídajících kódům kombinované nomenklatury 1905 90 60, 1905 90 90 a 2103 90 90, k jejichž fyzickému příchodu do Unie došlo před 4. červencem 2013, do 5. srpna 2013, a to i v případě, že společný vstupní doklad nebyl příslušnému orgánu zaslán nejméně jeden pracovní den před fyzickým příchodem zásilky, jak požaduje čl. 3 odst. 2, jsou-li však splněny ostatní požadavky stanovené v článku 3.
Členské státy povolí dovoz zásilek produktů, které v příloze I odpovídají kódům kombinované nomenklatury 1905 90 60, 1905 90 90 a 2103 90 90, které nesplňují podmínky stanovené v článcích 3 a 4, do 5. října 2013, pokud příslušný orgán odebral vzorek a provedl analýzu v souladu s čl. 5 odst. 3.
Článek 10
Přezkum opatření
Opatření stanovená tímto rozhodnutím budou pravidelně přezkoumávána, aby v případě potřeby zohledňovala nový vývoj v otázce přítomnosti nepovolených geneticky modifikovaných organismů v produktech, které pocházejí nebo jsou zasílány z Číny, nebo vědecký a technický pokrok v oblasti metod odběru vzorků a analýzy stanovených v tomto rozhodnutí.
Článek 11
Zrušení
Rozhodnutí 2008/289/ES se zrušuje.
Odkazy na zrušené rozhodnutí se považují za odkazy na toto rozhodnutí.
Článek 12
Vstup v platnost
Toto rozhodnutí vstupuje v platnost dvacátým dnem po vyhlášení v Úředním věstníku Evropské unie.
PŘÍLOHA I
SEZNAM PRODUKTŮ
|
Produkt |
Kód KN |
|
Rýže v plevách (neloupaná nebo surová) |
1006 10 |
|
Loupaná rýže (rýže cargo nebo hnědá rýže) |
1006 20 |
|
Poloomletá nebo celoomletá rýže, též leštěná nebo hlazená |
1006 30 |
|
Zlomková rýže |
1006 40 00 |
|
Rýžová mouka |
1102 90 50 |
|
Krupice a krupička z rýže |
1103 19 50 |
|
Pelety z rýže |
1103 20 50 |
|
Zrna rýže ve vločkách |
1104 19 91 |
|
Obilná zrna rozválcovaná nebo ve vločkách (kromě zrn ovsa, pšenice, žita, kukuřice a ječmene a rýžových vloček) |
1104 19 99 |
|
Rýžový škrob |
1108 19 10 |
|
Přípravky pro dětskou výživu, v balení pro drobný prodej |
1901 10 00 |
|
Těstoviny nevařené, nenadívané ani jinak nepřipravené, obsahující vejce |
1902 11 00 |
|
Těstoviny nevařené, nenadívané ani jinak nepřipravené, neobsahující vejce |
1902 19 |
|
Nadívané těstoviny, též vařené nebo jinak připravené |
1902 20 |
|
Ostatní těstoviny (jiné než těstoviny nevařené, nenadívané ani jinak nepřipravené, a jiné než nadívané těstoviny, též vařené nebo jinak připravené) |
1902 30 |
|
Výrobky z obilovin získané bobtnáním nebo pražením z rýže |
1904 10 30 |
|
Přípravky typu „müsli“ z nepražených obilných vloček |
1904 20 10 |
|
Připravené potraviny získané z nepražených obilných vloček nebo ze směsí nepražených obilných vloček a pražených obilných vloček nebo nabobtnalých obilovin z rýže (kromě přípravků typu „müsli“ z nepražených obilných vloček) |
1904 20 95 |
|
Rýže předvařená nebo jinak připravená, jinde neuvedená ani nezahrnutá (kromě mouky, krupice a krupičky, potravinových přípravků získaných bobtnáním nebo pražením nebo z nepražených obilných vloček nebo ze směsí nepražených obilných vloček a pražených obilných vloček nebo nabobtnalých obilovin) |
1904 90 10 |
|
Rýžový papír |
ex190590 20 |
|
Sušenky |
1905 90 45 |
|
Výrobky tlačené nebo pěnové, aromatizované nebo solené |
1905 90 55 |
|
Výrobky tlačené nebo pěnové, slazené (např. ovocné koláče, sladký chléb, panettone, sněhové pečivo, vánoční štola, croissanty a jiné pekařské výrobky) |
1905 90 60 |
|
Výrobky tlačené nebo pěnové, neslazené, nearomatizované ani nesolené (např. pizzy, quiche a jiné neslazené pekařské výrobky) |
1905 90 90 |
|
Omáčky a přípravky pro omáčky; směsi koření a směsi přísad pro ochucení |
2103 90 90 |
|
Otruby, vedlejší mlýnské produkty a jiné zbytky, též ve tvaru pelet, získané po prosévání, mletí nebo jiném zpracování rýže s obsahem škrobu nepřesahujícím 35 % hmotnostních |
2302 40 02 |
|
Otruby, vedlejší mlýnské produkty a jiné zbytky, též ve tvaru pelet, získané po prosévání, mletí nebo jiném zpracování rýže, jiné než s obsahem škrobu nepřesahujícím 35 % hmotnostních |
2302 40 08 |
PŘÍLOHA II
Metody odběru vzorků a analýzy pro účely úřední kontroly týkající se nepovoleného geneticky modifikovaného organismu v produktech z rýže pocházejících z Číny
1. Obecná ustanovení
Vzorky určené pro úřední kontrolu nepřítomnosti geneticky modifikované rýže v produktech z rýže se odebírají podle metod popsaných v této příloze. Takto získané hromadné vzorky se považují za reprezentativní pro partie, z nichž byly odebrány.
2. Odběr vzorků
2.1 Odběr vzorků z partií hromadných produktů a příprava analytických vzorků
Počet dílčích vzorků, ze kterých je sestaven hromadný vzorek, a příprava analytických vzorků musí být v souladu s doporučením 2004/787/ES a nařízením (ES) č. 152/2009 pro krmiva. Velikost laboratorního vzorku musí být 2,5 kg, avšak u zpracovaných potravin nebo krmiv může být snížena na 500 g. Pro účely čl. 11 odst. 5 nařízení (ES) č. 882/2004 se sestaví druhý laboratorní vzorek z hromadného vzorku.
2.2 Odběr vzorků u balených potravin a krmiv
Počet dílčích vzorků pro sestavení hromadného vzorku a příprava analytických vzorků musí být v souladu s ►M1 CEN/TS 15568:2007 ◄ nebo s obdobnou normou. Velikost laboratorního vzorku musí být 2,5 kg, avšak u zpracovaných potravin nebo krmiv může být snížena na 500 g. Pro účely čl. 11 odst. 5 nařízení (ES) č. 882/2004 se sestaví druhý laboratorní vzorek z hromadného vzorku.
3. Analýza laboratorního vzorku
Laboratorní analýza v místě původu se provede v laboratoři určené úřadem AQSIQ a před propuštěním do volného oběhu v Unii v úřední kontrolní laboratoři určené členským státem. Screeningové testy se provádějí pomocí PCR v reálném čase v souladu s metodou zveřejněnou Evropskou referenční laboratoří pro geneticky modifikované potraviny a krmiva ( 9 ), nejméně u následujících genetických prvků: promotoru 35S CAMV (viru žilkové mozaiky květáku), terminátoru NOS (nopalinsyntázy) z Agrobacterium tumefaciens a modifikovaných genů CryIAb, CryIAc a/nebo CryIAb/CryIAc z Bacillus thuringiensis.
V případě vzorků zrn odebere určená kontrolní laboratoř z homogenizovaného laboratorního vzorku čtyři analytické vzorky po 240 g (odpovídající 10 000 zrn rýže). Tyto čtyři analytické vzorky se rozemelou a dále analyzují odděleně. Z každého analytického vzorku se připraví dvě extrakce. U každé extrakce se podle screeningových metod podrobně uvedených dále v bodě 4 provede jeden test PCR pro každý geneticky modifikovaný genetický prvek.
U zpracovaných produktů jako mouka, těstoviny nebo škrob může být analytický vzorek o velikosti 125 g připraven z homogenizovaného laboratorního vzorku. Tento analytický vzorek se rozemele a připraví se z něj dvě extrakce a podle screeningových metod podrobně uvedených v bodě 4 a u každé extrakce se provede jeden test PCR pro každý geneticky modifikovaný genetický prvek.
Pokud se má za to, že je nejméně jeden geneticky modifikovaný genetický prvek detekován přinejmenším v jednom analytickém vzorku zásilky v souladu s pokyny stanovenými ve zprávě referenční laboratoře Evropské unie (RL EU pro GMO), zásilka se považuje za nevyhovující.
|
4. |
Použijí se tyto analytické metody: a) Pro screening promotoru 35S CAMV (viru žilkové mozaiky květáku) a terminátoru NOS (nopalinsyntázy) z Agrobacterium tumefaciens. ISO 21570: 2005 Metody pro detekci geneticky modifikovaných organismů a odvozených produktů – Metody založené na kvantitativním stanovení kyseliny nukleové. Příloha B1. H.-U. Waiblinger a kol., 2008, „Validation and collaborative study of a P35S and T-nos duplex real-time screening method to detect genetically modified organisms in food products“, Eur. Food Res. and Technol., Volume 226, s. 1221 až 1228. E. Barbau-Piednoir a kol., 2010, „SYBR®Green qPCR screening methods for the presence of ‚35S promoter‘ and ‚NOS terminator‘ elements in food and feed products“, Eur. Food Res. and Technol., Volume 230, s. 383 až 393. R. Reiting, H. Broll, H.-U. Waiblinger, L. Grohmann, 2007, „Collaborative study of a T-nos real-time PCR method for screening of genetically modified organisms in food products“, J. Verbr. Lebensm., 2, s. 116 až 121. b) Pro screening modifikovaných genů CryIAb, CryIAc a/nebo CryIAb/CryIAc z Bacillus thuringiensis. E. Barbau-Piednoir a kol. (v tisku), „Four new SYBR®Green qPCR screening methods for the detection of Roundup Ready®, LibertyLink® and CryIAb traits in genetically modified products“, Eur. Food Res. and Technol., DOI 10.1007/s00217-011-1605-7. Po ověření specifičnosti metod Evropskou referenční laboratoří pro geneticky modifikované potraviny a krmiva na širokém spektru různých vzorků rýže z Číny se taková metoda bude považovat za vhodnou pro tyto účely screeningu. |
|
5. |
Při použití výše uvedených screeningových metod se zohlední pokyny uvedené v dokumentu, který zveřejnila ►M1 RL EU pro GMO ◄ . |
PŘÍLOHA III
VZOR OSVĚDČENÍ O ZDRAVOTNÍ NEZÁVADNOSTI
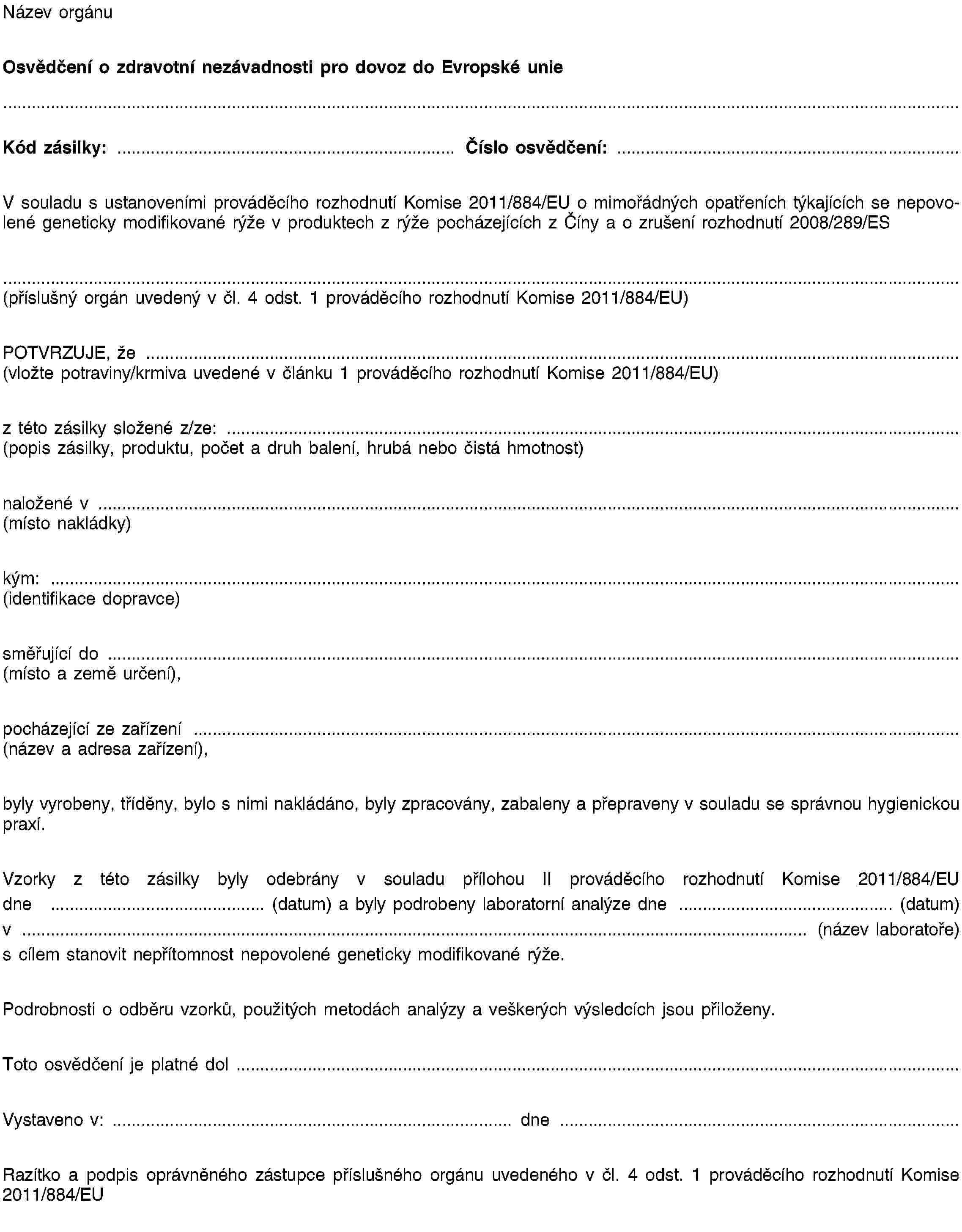
PŘÍLOHA IV
VZOR ANALYTICKÉ ZPRÁVY
Poznámka: Vyplňte prosím formulář v příloze pro každý zkoušený vzorek
|
Údaj, který se uvede ve zprávě |
Poskytnuté informace |
|
Název a adresa zkušební laboratoře (1) |
|
|
Identifikační kód analytické zprávy (1) |
<<000>> |
|
Identifikační kód laboratorního vzorku (1) |
<<000>> |
|
Velikost laboratorního vzorku (1) |
X kg |
|
V případě rozdělení vzorku: Počet a velikost analytických vzorků |
X analytických vzorků po Y g |
|
Počet a velikost analyzovaných zkušebních dávek (1) |
X zkušebních dávek po Y mg |
|
Celkové množství analyzované DNA (1) |
X ng/PCR |
|
Test sekvence(í) DNA proveden pro (1): |
U každého z následujících uveďte odkaz na použitou metodu a průměrné zjištěné číslo Ct. marker rýže: promotor 35S: terminátor NOS: CryIAb/CryIAc: |
|
Test další sekvence (dalších sekvencí) proveden pro (1): |
Status validace: (např. mezilaboratorní validace, interní validace [uveďte prosím podle jaké normy, pokynu]) Popis detekovaných sekvencí DNA (referenční + cílové geny): Specifičnost metody (screening, specifická pro konstrukt nebo specifická pro případ): Absolutní limit detekce (počet kopií): Praktický limit detekce (limit detekce týkající se analyzovaného vzorku), je-li stanoven: |
|
Popis pozitivních kontrol cílové DNA a referenčních materiálů (1) |
Zdroj a povaha pozitivních kontrol a referenčních materiálů (např. plasmid, genomická DNA, CRM …) |
|
Informace o pozitivní kontrole (1) |
Uveďte prosím množství (v ng DNA) analyzované pozitivní kontroly a průměrné zjištěné číslo Ct |
|
Poznámky |
|
|
(1) Povinné údaje |
|
( 1 ) Úř. věst. L 31, 1.2.2002, s. 1.
( 2 ) Úř. věst. L 268, 18.10.2003, s. 1.
( 3 ) Úř. věst. L 96, 9.4.2008, s. 29.
( 4 ) Úř. věst. L 348, 24.11.2004, s. 18.
( 5 ) Úř. věst. L 54, 26.2.2009, s. 1.
( 6 ) Úř. věst. L 165, 30.4.2004, s. 1.
( 7 ) Úř. věst. L 194, 25.7.2009, s. 11.
( 8 ) Úř. věst. L 21, 28.1.2004 s. 11.
( 9 ) http://gmo-crl.jrc.ec.europa.eu